サイズ、長さ、角度などの特定のパラメーターを原子スケールで決定することは容易ではありません。これらのパラメータは重要であるため、科学者は原子レベルでパラメータを推定または計算する方法を開発しました。結合順序と結合長は、一対の原子間の結合の種類と強度を示す 2 つの重要なパラメーターです。
この記事では、
1. 結合順序と結合長とは
2. 結合順序と結合長の計算方法
– 結合順序の計算方法
– 結合長の計算方法
結合順序と結合長とは
結合長と結合順序は、共有結合に関連する 2 つのパラメーターです。結合順序は 2 つの原子間の化学結合の数であり、結合長は共有結合している 2 つの原子核間の距離です。 この記事では、結合順序と結合長を原子レベルで計算する方法について説明します。
債券注文の計算方法
結合順序は、2 つの原子間の化学結合の数です。結合の安定性を示します。共有結合では、結合順序は共有電子の数です。たとえば、単結合で結合した原子のペアの結合次数は 1 ですが、二重結合で結合した原子のペアの結合次数は 2 です。ゼロ結合次数は、原子間に結合がないことを示します。分子の安定性は、結合次数の増加とともに増加します。共鳴結合を持つ分子は整数である必要はありません。 2 つの原子を持つ共有結合化合物では、最初にルイス構造を描画し、次に原子間の結合の種類 (ゼロ結合、単結合、二重結合、または三重結合) を決定することによって、一対の原子間の結合順序が決定されます。たとえば、水素ガスの結合次数は次のように決定されます。
<オール>H:H
- 結合数/価電子対の決定
1 対の電子、したがって結合次数は 1 です。
2 つ以上の原子がある場合、結合順序は次のように決定されます。例を参照してください:硝酸イオン。
<オール>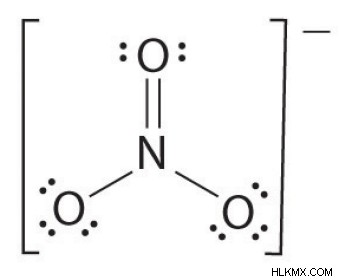
- 個々の原子間の結合グループの数 (アンモニアによると、その 3)
- したがって、債券の順序 =債券の総数 / 債券グループの数
=4/3
=1.33
したがって、硝酸イオンの結合次数は 1.33 です
結合長の計算方法
結合長は、共有結合している 2 つの原子核間の距離です。結合長は通常 0.1 ~ 0.2 nm の範囲です。 2 つの類似した原子が結合している場合、結合長の半分は共有結合半径と呼ばれます。 .結合長は、2 つの原子の結合電子の数または結合順序に依存します。結合次数が高いほど、正に荷電した原子核の強い引っ張り力により、結合長が短くなります。結合長の単位はピコメートルです .単結合、二重結合、三重結合では、結合長は
の順に長くなります三重結合<二重結合<単結合
電気陰性度は、異なる電気陰性度を持つ 2 つの原子間の結合長を計算するために使用できます。次の実験式は、結合長を計算するために Shoemaker と Stevenson によって提案されました。
dA-B =rA + rB – 0.09 (xA – xB )
dA-B は 2 つの原子 A と B の間の結合距離、rA そして rB は A と B の共有結合半径であり、
(xA – xB ) は、A と B の電気陰性度の差です。
別の方法を使用して、おおよその結合長を計算します。この方法では、最初にルイス構造を描き、共有結合の種類を決定します。次に、Cordero et al によって行われた研究に基づいて作成されたチャート* を使用します .、ピュッコと渥美 、各原子によって作られる結合の対応する半径が決定されます。次に、結合長は、2 つの半径の合計をとることによって決定されます。たとえば、二酸化炭素の結合長を決定する場合、最初にルイス構造が描かれます。
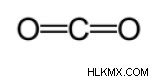
グラフによると、炭素二重結合の共有半径は 67 ピコメートル、酸素二重結合の共有半径は 57 ピコメートルです。したがって、二酸化炭素の結合長は約 124 ピコメートル (57 pm+67 pm) です。
*コバレントチャートはこちら
コーデロ、ベアトリス他「共有結合半径の再考」ダルトン トランザクション 21 (2008):2832-2838.
リブテキスト。 「ボンドの順序と長さ」化学LibreTexts。 Libretexts、2016 年 12 月 5 日。ウェブ。 2017 年 1 月 10 日
Lister、Ted、Janet Renshaw。上級レベルの化学を理解する。 N.p.:ネルソン・ソーンズ、2000年。印刷。
Pratiyogita Darpan. 「電子構造に関連する元素の特性」。競争科学ビジョン 1998 年 8 月:n.ページ。印刷します。
Pyykkö、Pekka、渥美道子。 「元素Li–E112の分子二重結合共有半径」。 Chemistry–A European Journal 15.46 (2009):12770-12779.