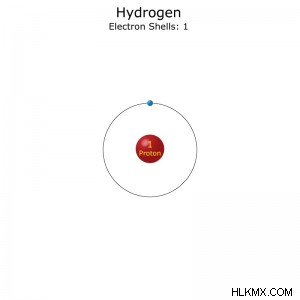
水素 (H) は、周期表の最初の要素であり、宇宙で最も豊富な要素です。これは、その特性、用途、および供給源を含む、水素に関する事実のコレクションです。

水素の基本情報
名前: 水素
原子番号: 1
元素記号: H
グループ: 1
期間: 1
ブロック:
エレメント ファミリー: 非金属
原子質量: [1.00784; 1.00811] IUPAC ガイドライン
1.008 は通常、単一の値に使用されます
電子配置: 1秒
発見: 1766年のヘンリー・キャベンディッシュ。
キャベンディッシュは、水素を元素として認識した最初の人でした。他の人たちは、水素ガスを元素として特定せずに、水素ガスのサンプルを準備していました。キャベンディッシュは彼の発見を「可燃性空気」と呼んだ。 Antoine Lavoisier は 1783 年に「水素」という名前を提案し、その後すぐに水素が採用されました。
名前の由来: Hydro (ギリシャ語で「水」) Gene (ギリシャ語で「形成」)。 Lavoisier は、水素を酸素と燃焼させると水が生成されることを示しました。
一般的な同位体:
H
プロチウムは最も一般的な同位体です。陽子1個と電子1個です。天然水素の 99.98% はプロチウムです。
H
重水素は、陽子 1 個、中性子 1 個、電子 1 個です。この同位体は一般に文字 D で表されます。名前はギリシャ語の「deuteros」に由来します。 」は「2番目」を意味します。自然に発生する水素の約 0.02% は重水素です。
H
トリチウムには、陽子 1 個、中性子 2 個、電子 1 個が含まれています。この同位体は一般に文字 T で表されます。名前はギリシャ語の「tritos」に由来します。 」は「第三」を意味します。トリチウムは放射性であり、半減期が 12.32 ± 0.02 年の β 崩壊によって He-3 に崩壊します。自然に発生する水素の 10% はトリチウムです。

物理データ
密度: 0.000082g/cm
融点: 13.99 K (-259.16 ºC または -434.182 ºF)
沸点: 20.271 K (-252.879 ºC または -423.182 ºF)
トリプルポイント: 7.041 kPa で 13.8033 K
重要なポイント: 1.2858 MPa で 32.938 K
20ºC での状態: ガス
融合の熱: H2 に対して 0.117 kJ/mol .
気化熱: H2 に対して 0.904 kJ/mol .
モル熱容量: H2 に対して 28.836 J/mol·K .
原子データ
原子半径: 1.10Å
共有半径: 0.32Å
ファン デル ワールス半径: 1.2Å
電子親和力: 72.769 kJ/mol
電気陰性度: (ポーリングスケール):2.20
1 イオン化エネルギー: 1312.05 kJ/mol
一般的な酸化状態: 1、-1

豆知識
- 水素は元素の中で最も軽いです。
- 水素は、宇宙の元素質量の約 75% を占める最も豊富な元素です。
- 常温常圧の水素ガスは無色無臭です。
- 常温常圧の水素ガスは、空気の 14 分の 1 の軽さです。とても軽いので、地球の重力を逃れて宇宙に出ることができます。
- 水素ガスは、酸素と混合すると非常に可燃性です。水素ガスの燃焼は、有名なヒンデンブルク飛行船の事故の原因でした。
- 水素ガスを燃焼させると水が生成されます。
- 水素ガスは、金属を酸と反応させることで生成できます。
- 水素の陽イオンはハイドロンと呼ばれます。負の水素イオンは水素化物です。
- 水素は、産業界でアンモニアの生成と化石燃料の処理に広く使用されています。
- 多くの場合、水素は水の電気分解によって生成されます。また、加熱された炭素または金属上の酸の反応に蒸気を流すことによっても調製されます.
周期表の元素の詳細をご覧ください。