主な違い – 超共役と共鳴
共有化合物では、原子間に主に 2 種類の化学結合が見られます。シグマ結合とパイ結合です。単結合は常にシグマ結合です。二重結合は、シグマ結合とパイ結合で構成されています。ただし、原子軌道間のオーバーラップにより、両方のタイプの結合が形成されます。超共役と共鳴という用語は、分子の安定化に関与する 2 つの方法を説明するために使用されます。超共役と共鳴の主な違いは、超共役にはシグマ結合と p 軌道または pi 結合の間の相互作用が含まれるのに対し、共鳴には pi 結合間の相互作用が含まれることです。
対象となる主な分野
1.超共役とは
– 定義、メカニズム、および例
2.レゾナンスとは
– 定義、メカニズム、および例
3.超共役と共鳴の違いは何ですか
– 主な相違点の比較
重要な用語:原子軌道、超共役、パイ結合、共鳴、シグマ結合

超共役とは
超共役は、シグマ結合とパイ結合の間の相互作用による分子の安定化効果です。ここで、シグマ軌道は、隣接する空の p 軌道、部分的に満たされた p 軌道、または pi 軌道と相互作用します。この相互作用は、これらの軌道の重なりです。これにより、結合電子により多くのスペースを与える拡張分子軌道が形成されます。次に、電子間の反発力が減少します。その結果、分子は安定します。通常、超共役は、C-H シグマ結合の結合電子が、隣接する炭素の 2p または pi 軌道と重なり合うことによって発生します。
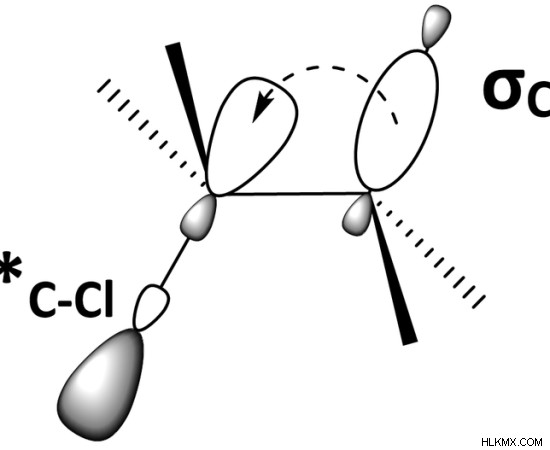
図 1:結合性軌道 (C-H) と反結合性軌道 (C-Cl) の重なり
超共役は、化学結合の結合長に影響します。通常、2 つの原子間のシグマ結合は、同じ 2 つの原子間のパイ結合よりも長くなります。超共役により、シグマ結合の長さが短くなり、パイ結合の長さが長くなります。さらに、カルボカチオンの安定性を高めるのに役立ちます。
レゾナンスとは
共鳴とは、パイ軌道での結合電子の非局在化による分子の安定化です。電子は原子や分子内で固定された位置を持たないため、あちこち自由に動き回ることができます。したがって、孤立電子およびパイ結合電子は、安定状態を得るために、ある位置から別の位置に移動することができます。これを共鳴と呼びます。分子の最も安定した形態を決定するために、特定の分子が持つことができるすべての可能な構造を示す共鳴構造を使用します。
共鳴構造は、同じ数の電子と同じ分子式を持ちます。分子内の原子のハイブリダイゼーションも、同じ数の非共有電子対とともに、すべての共鳴構造で同じでなければなりません.
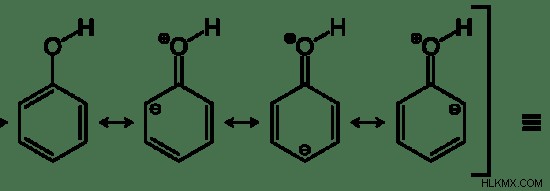
図 2:フェノールの共鳴構造
上の画像は、フェノールのすべての可能な共鳴構造を示しています。共鳴構造の最後に、フェノール分子の元の構造が示されています。これは、実際の分子に純粋な二重結合がないことを示しています。 3 つの二重結合の代わりに pi 電子雲があります。したがって、共鳴は共鳴構造に中間構造を与えます。
超共役と共鳴の違い
定義
超共役: 超共役は、シグマ結合とパイ結合の間の相互作用による分子の安定化効果です。
共鳴: 共鳴は、パイ軌道の結合電子の非局在化による分子の安定化です。
関与する軌道
超共役: 超共役には、シグマ結合軌道と p 軌道または pi 結合軌道が含まれます。
共鳴: 共鳴には、パイ結合軌道のみが含まれます。
絆の長さ
超共役: 超共役により、シグマ結合の長さが短くなります。
共鳴: 共鳴はシグマ結合には影響しません。
結論
超共役は共鳴の拡張です。どちらの方法も電子の非局在化によって分子の安定化を引き起こすためです。ただし、超共役には、パイ結合電子とともにシグマ結合電子の非局在化が含まれますが、共鳴はパイ軌道間の相互作用を介して非局在化を引き起こします。これが超共役と共鳴の違いです。