主な違い – 単結合、二重結合、三重結合
化学結合は、2 つの原子の電子と原子核の間に力を確立することにより、分子内の原子を結合します。化学反応は、化学結合の確立または切断によって制御されます。結合には、共有結合、イオン結合、ファンデルワールス結合など、さまざまな種類があります。結合の性質は、分子の性質、固体の種類(結晶性または非晶質)など、さまざまな側面によって異なります。共有結合は、2 つまたはより多くの電子。原子間で共有される電子の数によって、結合の数が決まります。シングルでもダブルでもトリプルでも。したがって、一重結合、二重結合、三重結合は共有結合です。単一二重結合と三重結合の主な違いは、共有電子の数です。 共有数が電子対1個の場合、結合は単結合になりますが、2個の原子が2対(電子4個)で結合した場合、二重結合になります。三重結合は、電子の 3 つのペア (6 つの原子) を共有することによって形成されます。 これらの共有電子は、一般に価電子として知られています。この記事では、
1. 単結合とは?
– 定義、プロパティ、例
2. 二重結合とは?
– 定義、プロパティ、例
3.三重結合とは
– 定義、プロパティ、例
4. シングル ダブル ボンドとトリプル ボンドの違いは何ですか? 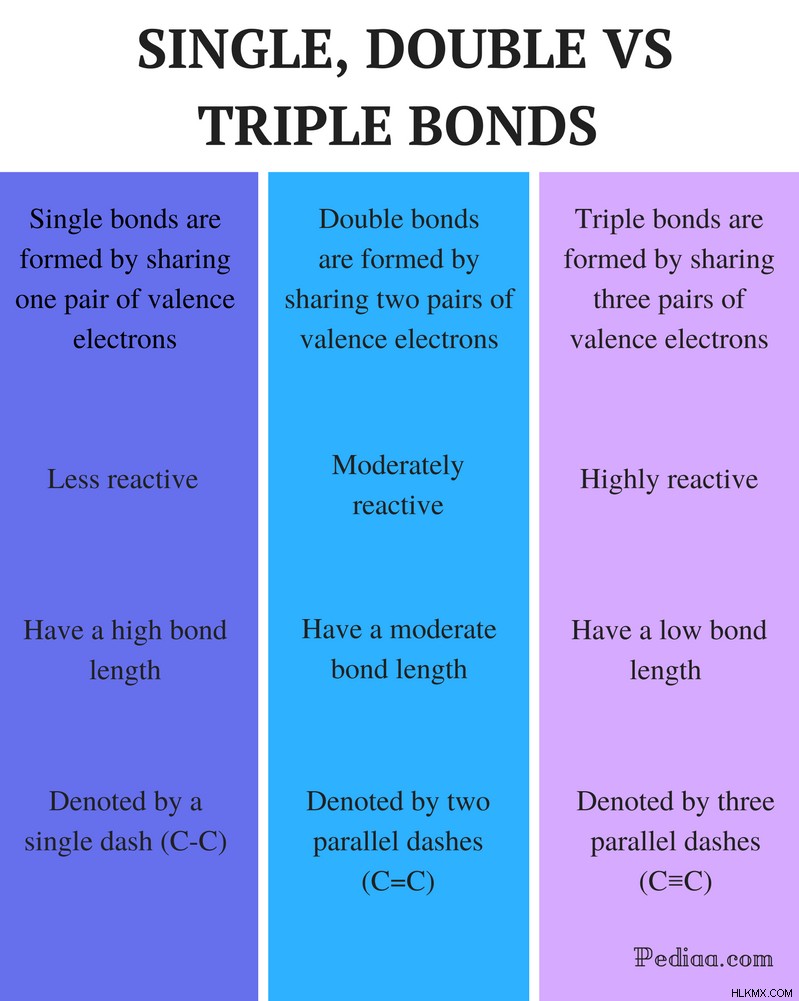
単結合とは
単結合は、隣接する 2 つの原子間で 1 組の価電子を共有することによって形成されます。単結合は共有結合の最も単純な形式で、各原子が 1 つの価電子を提供します。これらの価電子は、原子の最外殻に位置しています。ここで、負に帯電した共有電子は、正に帯電した原子核によって引っ張られています。これらの引っ張り力は、原子を一緒に保持します。この配置は、単結合として知られています。単結合を持つ分子は、複数結合を持つ分子とは異なり、反応性が低くなります。さらに、それらは複数の結合よりも弱く、複数の結合と比較して原子間の引っ張り力が低いため、結合長が長くなります。単結合はダッシュ 1 つだけで表されます。例:C ̶ C. メタン、エタン、プロパンなどのアルカンは、単結合を持つ化合物の例です。
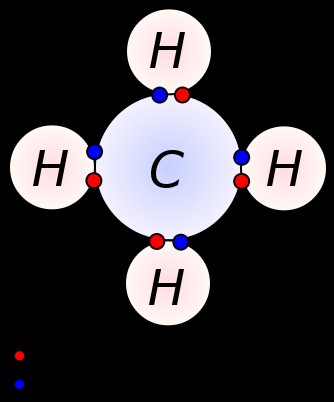
メタン
二重結合とは
二重結合は、原子の最も外側の軌道にある 2 対の価電子を共有することによって形成されます。二重結合を持つ化合物は、単結合化合物よりも反応性が高く、三重結合を持つ化合物よりも反応性が低くなります。二重結合は、2 つの平行なダッシュで示されます。例:C=C.二重結合を持つ化合物の例には、エチレン、プロペン、カルボニル化合物 (C=O)、アゾ化合物 (N=N)、イミン (C=N)、スルホキシド (S=O) などのアルケンが含まれます。
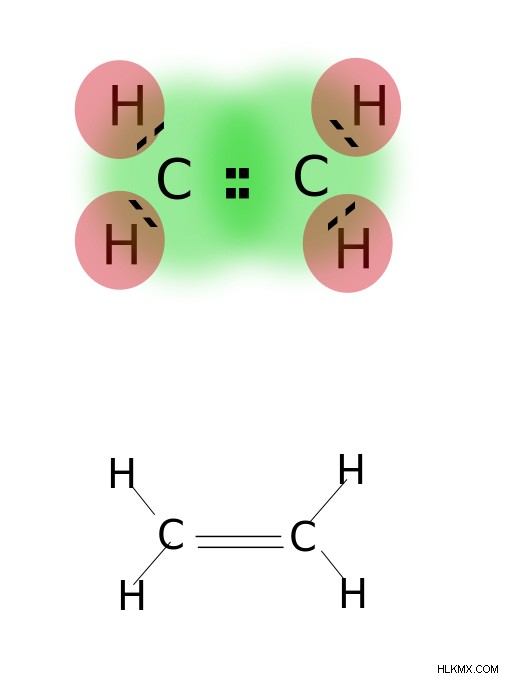
エチレン
三重結合とは
2 つの原子が 3 対の価電子 (6 つの価電子) を共有する場合、確立された結合は三重結合と呼ばれます。三重結合は、最も強力で反応性の高い共有結合です。単結合および二重結合と比較すると、三重結合は 2 つの原子間の引っ張り力が高いため、結合長が最も短くなります。三重結合は、2 つの原子の間の 3 つの平行なダッシュによって示されます。例:C≡C。三重結合を持つ化合物の例としては、窒素ガス (N≡N)、シアン化物イオン (C≡N)、アセチレン (CH≡CH)、一酸化炭素 (C≡O) などがあります。

アセチレン
単一の二重結合と三重結合の違い
定義:
シングル ボンド: 単結合は、1 対の価電子を共有することによって形成されます。
ダブル ボンド: 二重結合は、2 対の価電子を共有することによって形成されます。
トリプルボンド: 三重結合は、3 対の価電子を共有することによって形成されます。
反応性:
シングル ボンド: 単結合は反応性が低いです。
ダブル ボンド: 二重結合は適度に反応性があります。
トリプルボンド: 三重結合は反応性が高いです。
絆の長さ:
単結合: 単結合は長い結合長を持っています。
ダブルボンド: 二重結合は中程度の結合長を持っています。
トリプルボンド: 三重結合は結合力が弱いです。
表記:
単結合: 単結合はダッシュ (C-C) で表されます。
ダブルボンド: 二重結合は、2 つの平行なダッシュ (C=C) で表されます。
トリプルボンド: 三重結合は、3 つの平行なダッシュ (C≡C) で表されます。
例:
単結合: 例には、メタン、エタン、プロパン、ブタンなどのアルカンが含まれます。
二重結合: 例としては、エチレン、プロペン、カルボニル化合物 (C=O)、アゾ化合物 (N=N)、イミン (C=N)、スルホキシド (S=O) などがあります。
トリプル ボンド: 例としては、窒素ガス(N≡N)、シアン化物イオン(C≡N)、アセチレン(CH≡CH)、一酸化炭素(C≡O)などがあります。
参照:
クロウズ、マーティン。 有機化学の基礎 . N.p.:The Rosen Publishing Group, 2013. Print.Cracolice, Mark S. 基礎化学と数学の復習 .発行場所不明:Brooks Cole, 2006. Print.Manahan, Stanley E. Fundamentals of Environmental Chemistry .第3版。 N.p.:CRC Press、2011 年。Print.Gray、Harry B.、John D. Simon、William C. Trogler。 悪天候に立ち向かう .カリフォルニア州サウサリート:U サイエンス、1995 年。 画像提供: DynaBlast による「Covalent」 – Inkscape で作成 (CC BY-SA 2.5)、Commons Wikimedia 経由 「AzetylenElektr」自作 – Ф. А。 Деркач「Хімія」Л。 1968 (パブリック ドメイン) コモンズ ウィキメディア経由 「Etheen」 by Jcwf at nl.wikibooks (CC BY-SA 2.5) by Commons Wikimedia