シリコン は周期表の 14 要素です。これらのシリコンの事実には、一般的な情報と歴史とともに、化学的および物理的データが含まれています。

シリコン周期表セル
基本的なシリコンの事実
名前: シリコン
原子番号: 14
元素記号: シ
グループ: 14
期間: 3
ブロック: p
エレメント ファミリー: 半金属または半金属
原子質量: [28.084; 28.086]
マグネシウム サンプルの物理的および化学的履歴を反映するための IUPAC ガイドライン。原子質量の単一の値が必要な場合は、28.0855 を使用してください。
電子配置: [Ne]3s3p (略記)または 1s2s2p3s3p(フル)
発見: Jöns Jacob Berzelius 1824年。
ケイ素化合物は古くからありふれたものです。フリントは酸化ケイ素鉱物であり、多くの先史時代のツールの基礎でした。別のケイ素化合物である砂をガラスにしました。フランスの化学者 Antoine Lavoisier は、未知の元素を含むシリカの可能性について最初に書いた.何人かの化学者が電気分解を使用してシリコンを分離しようとしましたが、成功しませんでした。 Jöns Jacob Berzelius は、1824 年に化学プロセスを使用してシリコンを分離することに成功しました。
名前の由来: ハンフリー デービー卿は、1808 年にフリントを意味するラテン語の silex にちなんで slicium という名前を提案しました。彼はシリコンが金属であると信じ、接尾辞 -ium を追加しました。 1817 年、スコットランドの化学者トーマス トムソンは、シリコンが金属ではなく、ホウ素に似ていることを発見しました。彼は接尾辞を -on に交換して Davy の名前を変更しました。
同位体:
天然シリコン は、Si、Si および Si の 3 つの安定同位体で構成されています。宇宙線が大気中のアルゴンと反応すると、微量の Si が放出されます。 20 の放射性同位体が、Si から Si までの範囲の実験室条件下で生成されています。
Si
シリコン 28 は、14 個の中性子を含む安定同位体です。天然シリコンの 92.223% はシリコン 28 です。
Si
シリコン 29 は、15 個の中性子を含む安定同位体です。天然シリコンの 4.685% はシリコン 29 です。
Si
シリコン 30 は、16 個の中性子を含む安定同位体です。天然シリコンの 3.092% はシリコン 30 です。
Si
シリコン 32 は、18 個の中性子を含む放射性同位元素です。シリコン 32 は、宇宙放射線と大気中のアルゴンとの反応から娘粒子として形成されます。 β-崩壊によってさらに崩壊し、15,319年の半減期を持つPになります。

シリコン (Enricoros/Creative Commons)
物理データ
密度: 2.3296 グラム/cm
融点: 1687 K (1414 °C, 2577 °F)
沸点: 3538 K (3265 °C, 5909 °F)
20ºC での状態: 固体
融合の熱: 50.21kJ/モル
気化熱: 383kJ/モル
モル熱容量: 19.789 J/mol・K
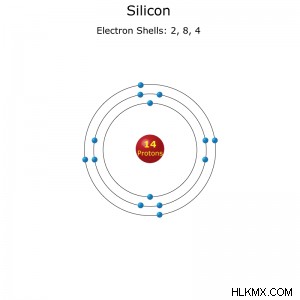
シリコン原子の電子殻配置。
原子データ
原子半径: 1.11 Å (経験値)
共有半径: 1.11Å
ファン デル ワールス半径: 2.10Å
電子親和力: 134.068 kJ/mol
電気陰性度: 1.90
1 イオン化エネルギー: 786.518 kJ/mol
2 イオン化エネルギー: 1577.134 kJ/mol
3 イオン化エネルギー: 3231.585 kJ/mol
4 イオン化エネルギー: 4355.523 kJ/mol
5 イオン化エネルギー: 16090.571 kJ/mol
6 イオン化エネルギー: 19805.55 kJ/mol
7 イオン化エネルギー: 23783.6 kJ/mol
8 イオン化エネルギー: 29287.16 kJ/mol
酸化状態: +4、-4 (共通)、+3、+2、+1、-1、-2、-3 (非共通)

アボガドロ計画のために超高純度シリコン単結晶球を手にするアヒム・ライストナー。クレジット:オーストラリア精密光学センター (ACPO)/Commonwealth Scientific and Industrial Research Organization (CSIRO)
楽しいシリコンの事実
- シリコン は、室温で青みがかった灰色の光沢のある 固体です。
- ケイ酸塩 (酸化ケイ素) は、地球の地殻に見られる最も一般的な鉱物です。これにより、ケイ素は地殻で 2 番目に豊富な元素になります。
- ケイ素は宇宙で 8 番目に多い元素です。
- シリコンは自然界に遊離しているものではありません。ほとんどの場合、その酸化物の形態であるケイ酸塩で見られます。例としては、アメジスト、瑪瑙、ジャスパー、オパール、シトリンなどの宝石とともに、水晶や砂が挙げられます。
- シリコンは主にガラス、セラミック、セメントに使用されます。
- シリコンは半導体の重要な構成要素です。ほぼすべての電子回路には、シリコン ベースの半導体材料が含まれています。
- アボガドロ プロジェクトは、シリコン単結晶を使用して標準キログラム質量を生成するプロジェクトです。これらの球体は、これまでに作成された中で最も丸い人工物と見なされています。
- シリコンは、電気炉で砂と炭素を加熱することによって商業的に精製されます。超高純度シリコンは、溶融塩電解技術を使用して抽出されます。
- シリコーン (ケイ素-酸素-炭化水素化合物) は、液体から硬い固体までさまざまで、接着剤、シーラント、潤滑剤、絶縁体としての使用など、多くの有用な特性を持っています。
- 珪藻は水からケイ素を吸収し、細胞壁に取り込みます。
- ケイ素を含む隕石はエアロライトとして知られています。
周期表の元素の詳細をご覧ください。







