アウフバウの原理とは?
アウフバウの原理では、電子はまず中性原子の中で最もエネルギーの低い電子殻を満たします。電子は、最低エネルギーの軌道から最高エネルギーの軌道まで軌道を埋めます。アウフバウの原理は、原子の電子構造を決定するのに役立ちます。
一般的な順序のシェルは、1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s です。この順序は、以下でも視覚的に表されます。
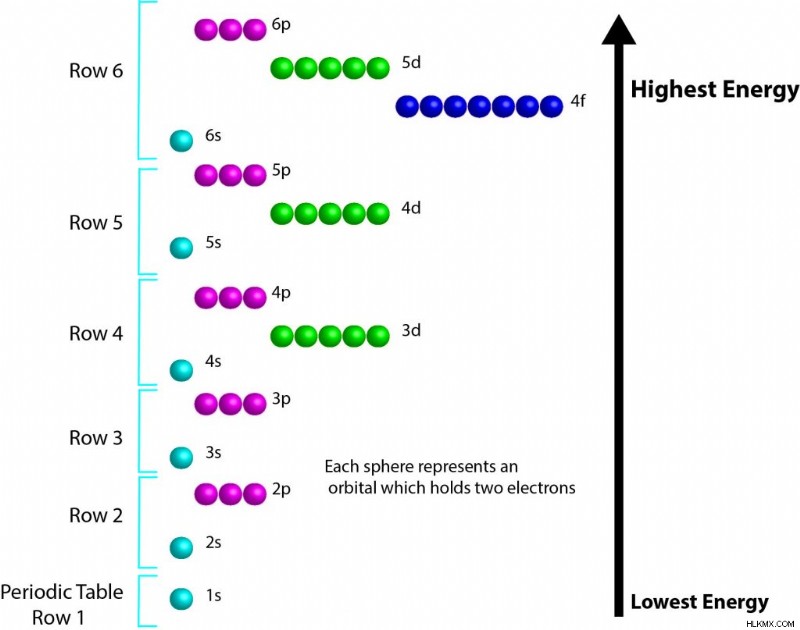
d 軌道と f 軌道の順序を覚えようとするときに、いくつかのパターンに気付くと役立つ場合があります。 p-軌道とs-軌道は、常にそれらが入っている行と同じ主エネルギー準位番号を持っています.dブロックが登場すると、その主エネルギー準位番号は常に行番号またはs-ブロックの後に来ます。 f ブロックの場合、原則エネルギー レベル数は常に現在の行よりも 2 少なくなります。この概念の便利な図は、電子構造に関するこのページにあります。相対エネルギーを視覚化する別の方法は、ここにあります。
s 殻は 2 つの電子を保持できます。 p準位は6個の電子を保持できます。 d準位は10個の電子を保持できます。最後に、f 軌道は最大 14 個の電子を保持します。
軌道を埋めるときは、パウリの排除原理とフントの法則にも従う必要があります。
Aufbau という言葉は、ドイツ語の build up に由来します。 または建設 .原子内の電子は、最低エネルギー準位から最高エネルギー準位まで積み上げられなければなりません。
マデルング ルール
次に満たされる軌道を決定する別の方法は、n の値を使用することです。 + l . n は主エネルギー準位または主量子数です。 l 軌道タイプまたは方位角量子数 - s=0、p=1、d=2、および f=3。 n が最も小さい軌道 +l 値が最初に入力されます。 2 つの軌道が同じ値の場合、n の値が小さい軌道が最初に満たされます。
Aufbau ルールの例外
アウフバウの原則にはいくつかの例外があります。これらは主に、周期表の d- (遷移金属) および f- (ランタニドおよびアクチニド) ブロックの原子に由来します。例外は、通常、原子番号が 40 より大きい元素からも発生します。これらの例外は、半分または完全に満たされた軌道から安定性が向上し、原子の全体的なエネルギーが低下するために発生します。これらの例では、電子が互いにさらに離れている可能性があるため、安定性が向上します。さらに、軌道間のエネルギー差は原子番号が大きいほど小さくなります。
例外のあるいくつかの要素:
- クロム (Cr) は、予想される [Ar]3d4 ではなく [Ar]3d4 になります。これは、部分的に満たされた軌道よりも半分満たされた軌道の方が安定性が向上するためです。
- 銅、銀、金 (すべて 11 列目) はすべて、代わりに d 軌道に入る s 軌道にあると予想される電子を持っています
- これらは例外の一部です。例外のある他の元素には、パラジウム、モリブデン、ロジウム、プラチナがあります。
さらに、電子は、アウフバウの規則に基づいて、常に最高エネルギーの殻から原子を離れるとは限りません。電子が離れると、原子はイオンになり、Aufbau 規則は適用されなくなります。
電子配置の例 アウフバウの原理の使用
炭素電子配置
炭素の原子番号は 6 です。したがって、炭素には 6 つの電子があります。アウフバウの原理によれば、2 個の電子を保持する最もエネルギーの低い殻 1s から充填を開始します。これで、残りの電子は 4 個になりました。 2つの電子は次に2s軌道に入ります。そして、残りの 2 個の電子は 2p 軌道に入ります。書き出すと、電子配置は 1s2s2p です。
カルシウムの電子配置
カルシウムの原子番号は 20 です。したがって、カルシウムには 20 個の電子があります。シェルごとに 20 まで数えるのではなく、単純化できます。最初の殻には 2 つの電子が入っていることがわかっています。そして次の殻には 8 個の電子が入っています。残りの電子は 10 個です。これは、電子配置の簡略法を使用するのと似ています。これまで、neon(LINK) の希ガス構成について説明してきました。ただし、カルシウムは 4 行目にあるため、アルゴンの希ガス構成にジャンプすることもできます。その後、2つの電子が残ります。次にエネルギーが低いのは 4s です。
カルシウムの電子配置は 1s2s2p3s3p4s または [Ar]4s です。
臭素電子配置
臭素は周期表の 4 行目にあり、原子番号は 35 です。上の図を使用すると、最大 35 個の電子を数えることができます。行 1 から 2 つの電子が得られます。行 2 は、行 3 と同様に 8 個の電子を提供します。これは合計 18 個の電子であり、アルゴン (Ar) の電子構成です。次に、行 4 に進みます。最初に 4s、次に主エネルギー数 3 を持つ d ブロックを取得します。臭素まで数えると、p ブロックに 5 つの電子があることがわかります。
したがって、電子配置は 1s2s2p3s3p4s 3d4p または [Ar]4s 3d4p です。
関連チュートリアル
- 電子殻構成の記述
- フンドの法則
- 周期表を理解する
- 量子数と軌道形状
- 電子軌道