元素の電子配置のこのリストには、原子番号の昇順ですべての元素が含まれています。
部屋を節約するために、構成は希ガスの略記です。これは、電子配置の一部が希ガス記号の元素記号に置き換えられたことを意味します。その希ガスの電子配置を調べて、残りの配置の前にその値を含めます。この表は、学習シートとして使用するために PDF としてダウンロードできます。
| NUMBER | 要素 | 電子構成 |
| 1 | 水素 | 1 秒 |
| 2 | ヘリウム | 1 秒 |
| 3 | リチウム | [He]2s |
| 4 | ベリリウム | [He]2s |
| 5 | ボロン | [He]2s2p |
| 6 | カーボン | [He]2s2p |
| 7 | 窒素 | [He]2s2p |
| 8 | 酸素 | [He]2s2p |
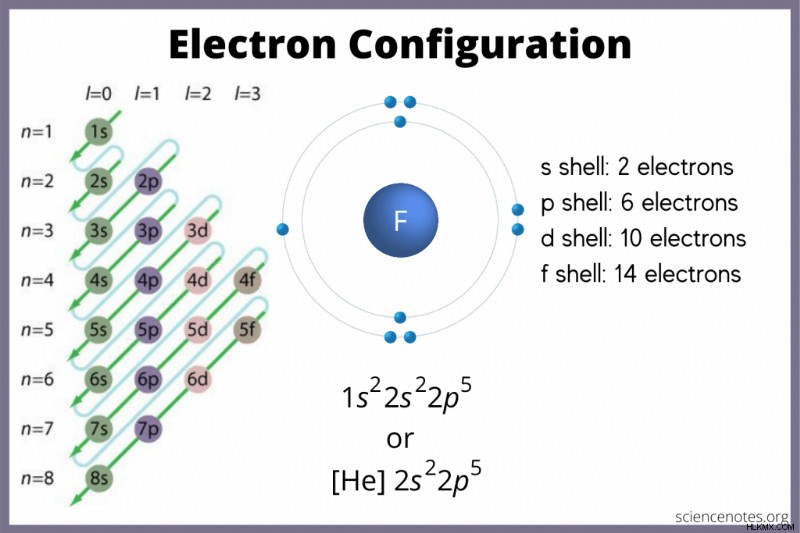
| 9 | フッ素 | [He]2s2p |
| 10 | ネオン | [He]2s2p |
| 11 | ナトリウム | [Ne]3s |
| 12 | マグネシウム | [Ne]3s |
| 13 | アルミニウム | [Ne]3s3p |
| 14 | シリコン | [Ne]3s3p |
| 15 | リン | [Ne]3s3p |
| 16 | 硫黄 | [Ne]3s3p |
| 17 | 塩素 | [Ne]3s3p |
| 18 | アルゴン | [Ne]3s3p |
| 19 | カリウム | [Ar]4s |
| 20 | カルシウム | [Ar]4s |
| 21 | スカンジウム | [Ar]3d4s |
| 22 | チタン | [Ar]3d4s |
| 23 | バナジウム | [Ar]3d4s |
| 24 | クロム | [Ar]3d4s |
| 25 | マンガン | [Ar]3d4s |
| 26 | 鉄 | [Ar]3d4s |
| 27 | コバルト | [Ar]3d4s |
| 28 | ニッケル | [Ar]3d4s |
| 29 | 銅 | [Ar]3d4s |
| 30 | 亜鉛 | [Ar]3d4s |
| 31 | ガリウム | [Ar]3d4s4p |
| 32 | ゲルマニウム | [Ar]3d4s4p |
| 33 | ヒ素 | [Ar]3d4s4p |
| 34 | セレン | [Ar]3d4s4p |
| 35 | 臭素 | [Ar]3d4s4p |
| 36 | クリプトン | [Ar]3d4s4p |
| 37 | ルビジウム | [Kr]5s |
| 38 | ストロンチウム | [Kr]5s |
| 39 | イットリウム | [Kr]4d5s |
| 40 | ジルコニウム | [Kr]4d5s |
| 41 | ニオブ | [Kr]4d5s |
| 42 | モリブデン | [Kr]4d5s |
| 43 | テクネチウム | [Kr]4d5s |
| 44 | ルテニウム | [Kr]4d5s |
| 45 | ロジウム | [Kr]4d5s |
| 46 | パラジウム | [Kr]4d |
| 47 | シルバー | [Kr]4d5s |
| 48 | カドミウム | [Kr]4d5s |
| 49 | インジウム | [Kr]4d5s5p |
| 50 | スズ | [Kr]4d5s5p |
| 51 | アンチモン | [Kr]4d5s5p |
| 52 | テルル | [Kr]4d5s5p |
| 53 | ヨウ素 | [Kr]4d5s5p |
| 54 | キセノン | [Kr]4d5s5p |
| 55 | セシウム | [Xe]6s |
| 56 | バリウム | [Xe]6s |
| 57 | ランタン | [Xe]5d6s |
| 58 | セリウム | [Xe]4f5d6s |
| 59 | プラセオジム | [Xe]4f6s |
| 60 | ネオジム | [Xe]4f6s |
| 61 | プロメチウム | [Xe]4f6s |
| 62 | サマリウム | [Xe]4f6s |
| 63 | ユーロピウム | [Xe]4f6s |
| 64 | ガドリニウム | [Xe]4f5d6s |
| 65 | テルビウム | [Xe]4f6s |
| 66 | ジスプロシウム | [Xe]4f6s |
| 67 | ホルミウム | [Xe]4f6s |
| 68 | エルビウム | [Xe]4f6s |
| 69 | ツリウム | [Xe]4f6s |
| 70 | イッテルビウム | [Xe]4f6s |
| 71 | ルテチウム | [Xe]4f5d6s |
| 72 | ハフニウム | [Xe]4f5d6s |
| 73 | タンタル | [Xe]4f5d6s |
| 74 | タングステン | [Xe]4f5d6s |
| 75 | レニウム | [Xe]4f5d6s |
| 76 | オスミウム | [Xe]4f5d6s |
| 77 | イリジウム | [Xe]4f5d6s |
| 78 | プラチナ | [Xe]4f5d6s |
| 79 | ゴールド | [Xe]4f5d6s |
| 80 | マーキュリー | [Xe]4f5d6s |
| 81 | タリウム | [Xe]4f5d6s6p |
| 82 | リード | [Xe]4f5d6s6p |
| 83 | ビスマス | [Xe]4f5d6s6p |
| 84 | ポロニウム | [Xe]4f5d6s6p |
| 85 | アスタチン | [Xe]4f5d6s6p |
| 86 | ラドン | [Xe]4f5d6s6p |
| 87 | フランシウム | [Rn]7s |
| 88 | ラジウム | [Rn]7s |
| 89 | アクチニウム | [Rn]6d7s |
| 90 | トリウム | [Rn]6d7s |
| 91 | プロタクチニウム | [Rn]5f6d7s |
| 92 | ウラン | [Rn]5f6d7s |
| 93 | ネプツニウム | [Rn]5f6d7s |
| 94 | プルトニウム | [Rn]5f7s |
| 95 | アメリシウム | [Rn]5f7s |
| 96 | キュリウム | [Rn]5f6d7s |
| 97 | バークリウム | [Rn]5f7s |
| 98 | カリフォルニア | [Rn]5f7s |
| 99 | アインスタイニウム | [Rn]5f7s |
| 100 | フェルミウム | [Rn]5f7s |
| 101 | メンデレビウム | [Rn]5f7s |
| 102 | ノーベリウム | [Rn]5f7s |
| 103 | ローレンシウム | [Rn]5f7s7p |
| 104 | ラザフォージウム | [Rn]5f6d7s |
| 105 | ドブニウム | *[Rn]5f6d7s |
| 106 | シーボーギウム | *[Rn]5f6d7s |
| 107 | ボーリウム | *[Rn]5f6d7s |
| 108 | ハッシウム | *[Rn]5f6d7s |
| 109 | マイトネリウム | *[Rn]5f6d7s |
| 110 | ダルムスタチウム | *[Rn]5f6d7s |
| 111 | レントゲニウム | *[Rn]5f6d7s |
| 112 | コペルニウム | *[Rn]5f6d7s |
| 113 | ニホニウム | *[Rn]5f6d7s7p |
| 114 | フレロビウム | *[Rn]5f6d7s7p |
| 115 | モスコビウム | *[Rn]5f6d7s7p |
| 116 | リバモリウム | *[Rn]5f6d7s7p |
| 117 | テネシン | *[Rn]5f6d7s7p |
| 118 | オガネソン | *[Rn]5f6d7s7p |
アスタリスクで示される値は、周期表の傾向に基づく予測です。実際の構成は検証されていません。
電子配置を見つける方法
電子配置は、電子が原子のどこにある可能性が高いかを示します。チャートがない場合でも、電子配置を見つけることができます。周期表の元素ブロックを使用して、最も高い電子軌道を見つけます。あるいは、グループ 1 (アルカリ金属) とグループ 2 (アルカリ土類金属) は s ブロック、グループ 2 から 12 は d ブロック、13 から 18 は p ブロックであり、下の 2 つの行は表 (ランタニドとアクチニド) は f ブロックです。期間または行番号 1 ~ 7 は、要素のエネルギー レベルです。
s軌道には最大2個の電子が入ります。 p 軌道は 6 個、d 軌道は 10 個、f 軌道は 14 個の電子を保持できます。しかし、軌道は重なります。 Madelung ルールは次の順序を示します:
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <4f <5d <6p <7s <5f <6d <7p>
オガネソン (要素 118 は、軌道の順序を示す良い例です。その電子配置は次のとおりです:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
または、元素 (この場合はラドン) の前に希ガスの記号を書き、追加情報を追加するだけです:
[Rn] 5f 6d 7s 7p
電子配置は、充填または半分充填されている場合に最も安定することに注意してください。また、原子の実際の電子配置は、相対論的効果、遮蔽などのために予測と異なる場合があります。
参考文献
- ラングミュア、アーヴィング (1919 年 6 月)。 「原子と分子における電子の配置」。 アメリカ化学会誌 . 41 (6):868–934. doi:10.1021/ja02227a002
- マーデルング、アーウィン (1936)。 Mathematische Hilfsmittel des Physikers .ベルリン:スプリンガー
- レイナー・キャナム、ジェフ。オーバートン、ティナ(2014)。 記述的無機化学 (第6版)。マクミラン教育. ISBN 978-1-319-15411-0.







