主な違い - 硫黄と二酸化硫黄
硫黄は、同素体として知られるさまざまな分子形態で見られる非金属です。明るい黄色の固体として地殻に見られます。硫黄は、大気中に純粋な元素として存在することはありません。それは硫黄の酸化物として見出されます。大気中に存在する主な酸化物は、二酸化硫黄と三酸化硫黄です。硫黄は、水素化物、硫化水素としても見つけることができます。硫黄と二酸化硫黄の主な違いは、硫黄は元素であるのに対し、二酸化硫黄は気体化合物であることです。
対象となる主な分野
1.硫黄とは
– 定義、物理的および化学的特性、用途
2.二酸化硫黄とは
– 定義、物理的および化学的特性、用途
3.硫黄と二酸化硫黄の関係
– 硫黄および二酸化硫黄
4.硫黄と二酸化硫黄の違いは何ですか
– 主な相違点の比較
重要な用語:同素体、非金属、硫黄、二酸化硫黄、三酸化硫黄

硫黄とは
硫黄は原子番号 16 の元素で、記号 S で表されます。この元素は周期表の p ブロックに属し、非金属です。硫黄の原子量は約 32 g/mol です。電子配置は [Ne] 3s3p として与えられます。 3 シェルに d 軌道があるため、硫黄は -2 から +6 までの異なる酸化状態を持つことができます。したがって、硫黄はさまざまな種類の化合物に含まれています。
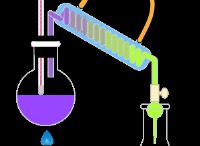
室温と圧力では、硫黄は固体です。この固体は S8 でできています ユニット。 S8 の構造 ユニットはさまざまな形で発生する可能性があります。これらの形態は、硫黄の同素体と呼ばれます。 S8 の最も一般的な構造 単位はクラウン構造と斜方晶構造です。硫黄の融点は 115.21℃、沸点は 444.6℃です。

図 1:固体硫黄
硫黄には約 25 の同位体があります。硫黄の最も豊富な同位体は S です。地球上のこの同位体の存在量は約 94% です。硫黄は、さまざまな種類の隕石に硫化物の形で含まれています。ほとんどの場合、硫黄は温泉や火山の近くで発生します。これまで、火山堆積物を採掘して硫黄元素を得ることができた。硫黄は、工業規模および実験室規模で有用なすべての硫黄含有化合物を生成するために使用されます。
二酸化硫黄とは
二酸化硫黄は、硫黄原子と酸素原子から構成されるガス状化合物です。二酸化硫黄の化学式は SO2 です。 .したがって、共有結合を介して2つの酸素原子に結合した硫黄原子で構成されています。 1つの酸素原子は、硫黄原子と二重結合を形成できます。したがって、硫黄原子は化合物の中心原子です。硫黄元素は最外軌道に 6 個の電子を持っているため、酸素原子と 2 つの二重結合を形成した後、さらに 2 個の電子が残り、孤立電子対として機能することができます。これにより、SO2 の形状が決まります 角度のある幾何学としての分子。
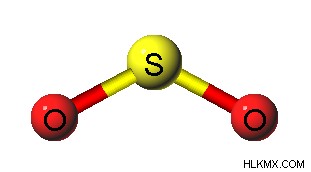
図 2:二酸化硫黄の角度の幾何学
二酸化硫黄は有毒ガスと見なされています。したがって、SO2 があれば 大気中では、大気汚染の指標になります。このガスは非常に刺激臭があります。二酸化硫黄の分子量は 64 g/mol です。室温で無色の気体です。融点は約-71C、沸点は-10Cです。
二酸化硫黄は、硫黄燃焼プロセスによって生成されます。そうでない場合、硫黄含有化合物を燃やすと、二酸化硫黄も生成される可能性があります。
S(s) + O2(g) → SO2(g)
この反応は発熱です。したがって、二酸化硫黄ガスとともにエネルギーを放出します。このエネルギーから生成される熱は非常に高いです。さらに、硫化鉄、硫化亜鉛などの硫黄含有化合物は、二酸化硫黄ガスを放出する可能性があります。
FeS2(s) + O2(g) → Fe2 O3(s) + SO2(g)
二酸化硫黄中の硫黄の酸化状態は +4 です。したがって、二酸化硫黄は、より高い酸化状態にある硫黄原子で構成される化合物の還元によっても生成されます。そのような例の 1 つは、銅と硫酸の反応です。ここで、硫酸中の硫黄は+6の酸化状態にあります。したがって、二酸化硫黄の +4 酸化状態に還元できます。
二酸化硫黄は、工業規模および実験室規模で多くの用途がある硫酸の製造に使用できます。二酸化硫黄も優れた還元剤です。硫黄の酸化状態は二酸化硫黄では +4 であるため、別の化合物を還元できる +6 酸化状態に容易に酸化できます。
硫黄と二酸化硫黄の関係
- 二酸化硫黄は、固体硫黄が酸素の存在下で燃焼すると生成されます。
硫黄と二酸化硫黄の違い
定義
硫黄: 硫黄は原子番号 16 の元素で、記号 S で表されます。
二酸化硫黄: 二酸化硫黄は、硫黄原子と酸素原子で構成される気体化合物です。
酸化状態
硫黄: 硫黄元素の酸化状態はゼロです。
二酸化硫黄: 二酸化硫黄中の硫黄の酸化状態は +4 です。
フェーズ
硫黄: 硫黄は室温で固相です。
二酸化硫黄: 二酸化硫黄は室温で気相です。
質量
硫黄: 硫黄の原子質量は 32 g/mol です。
二酸化硫黄: 二酸化硫黄の分子量は 64 g/mol です。
融点
硫黄: 硫黄の融点は約115.21℃です。
二酸化硫黄: 二酸化硫黄の融点は約-71℃です。
沸点
硫黄: 硫黄の沸点は約444.6℃です。
二酸化硫黄: 二酸化硫黄の沸点は約-10℃です。
結論
硫黄は、室温で気体である 2 つの主要な酸化物を形成します。それらは二酸化硫黄と一酸化硫黄です。二酸化硫黄は、硫黄の燃焼から生成できます。二酸化硫黄も硫黄原子で構成されていますが、異なる化学的および物理的特性を示します。硫黄と二酸化硫黄の主な違いは、硫黄が元素であるのに対し、二酸化硫黄は気体化合物であることです.