化学では、不飽和溶液 溶解できる溶質の最大量未満を含む化学溶液です。溶質は完全に溶解し、容器の底に未溶解の物質は残りません。
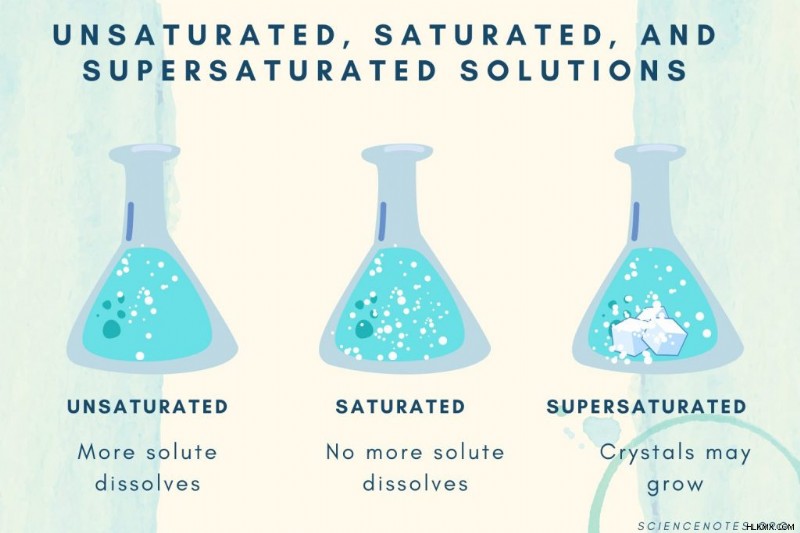
不飽和、飽和、過飽和
溶質濃度が増加するにつれて、溶液は不飽和から飽和、過飽和へと変化します。
| 彩度のタイプ | 定義 |
| 不飽和溶液 | 溶質が完全に溶解する溶液。より多くの溶質を加えて溶解することができます。濃度は飽和溶液よりも低くなっています。 |
| 飽和溶液 | それ以上溶質が溶けない溶液。飽和点では、すべての溶質が溶解しますが、溶質を追加すると未溶解のままになります。 |
| 過飽和溶液 | 飽和溶液よりも多くの溶質を含む溶液。通常、これにより、結晶化する傾向のある未溶解の材料が生じます。過飽和溶液には、通常の溶解度を超える溶解溶質が含まれることがあります。 |
飽和度と溶解度
溶媒に溶解する溶質の量は、その溶解度です。溶解度は溶媒に依存します。たとえば、塩は水に溶けますが、油には溶けません。水への固体の溶解度は通常、温度とともに増加します。たとえば、冷水よりも熱湯に多くの砂糖や塩を溶かすことができます。溶解度は圧力にも依存しますが、それはそれほど重要ではなく、日常の計算ではしばしば割り引かれます.
溶解度は温度に依存するため、高温では不飽和である溶液は、低温では飽和または過飽和になることさえあります。科学者や料理人は、通常、溶質が低温で完全に溶解しない場合に、熱を使用して不飽和溶液を調製します。ある量の溶質が不飽和溶液または飽和溶液を形成するか (またはまったく溶解しないか) を判断するには、溶解度表を参照してください。
不飽和溶液、飽和溶液、過飽和溶液を簡単な目視検査で区別できるとは限りません。場合によっては、3 種類の溶液すべてに未溶解物質が含まれていないことがあります。慎重な温度制御により、未溶解物質のない過飽和溶液を生成できます。これは過冷却ソリューションです。過冷却溶液を乱すと、平衡が乱れ、結晶化が開始されます。ホットアイスのデモンストレーションはこの原則に基づいています。
飽和および不飽和溶液の例
砂糖または塩を水にかき混ぜると、溶媒(水)に追加する砂糖または塩(溶質)の量に応じて、不飽和、飽和、または過飽和の溶液が形成されます.少量の溶質を加えると、すべてが溶解し、不飽和溶液が形成されます。溶質を追加し続けると、それ以上溶解しなくなるポイントに到達します。これは飽和溶液です。溶質をさらに追加すると、過飽和溶液が形成されます。
分子レベルでは、水に塩 (NaCl) を加えると、イオン結晶が Na と Clions に解離します。これらのイオンと水分子は運動エネルギーを持っているため、イオンが互いに跳ね返って NaCl を再形成することがあります。溶解した溶質が固体状態に戻るプロセスは、再結晶と呼ばれます .不飽和溶液では、再結晶した塩が再び溶解します。塩分を多くするとイオン濃度が上がります。最終的に、溶解と再結晶が同じ速度で起こるポイントが来ます。この平衡は化学式として書くことができます。
NaCl(s ) ⇆ NaCl(aq )
また
NaCl(s ) ⇆ Na(aq ) + Cl(aq )
参考文献
- ヘフター、G.T.; Tomkins, R.P.T (eds.) (2003)。 溶解度の実験的決定 .ワイリー・ブラックウェル。 ISBN 978-0-471-49708-0.
- ヒル、J. W.;ペトルッチ、R.H.;ら。 (2004) 一般化学 (第 4 版)。ピアソン。 ISBN:978-0131402836
- Ran, Y.; N.ジェイン; S.H.ヤルコウスキー (2001)。 「一般溶解度方程式(GSE)による有機化合物の水溶解度の予測」。 Journal of Chemical Information and Modeling . 41 (5):1208–1217. doi:10.1021/ci010287z