原子は非常に小さく、その電子殻は球状の殻というよりも雲のようなものであるため、原子のサイズを測定するのは簡単ではありません。原子半径とイオン半径は、最も一般的な原子サイズの測定値の 2 つです。原子半径とイオン半径の定義、それらの違い、周期表の傾向は次のとおりです。
原子半径
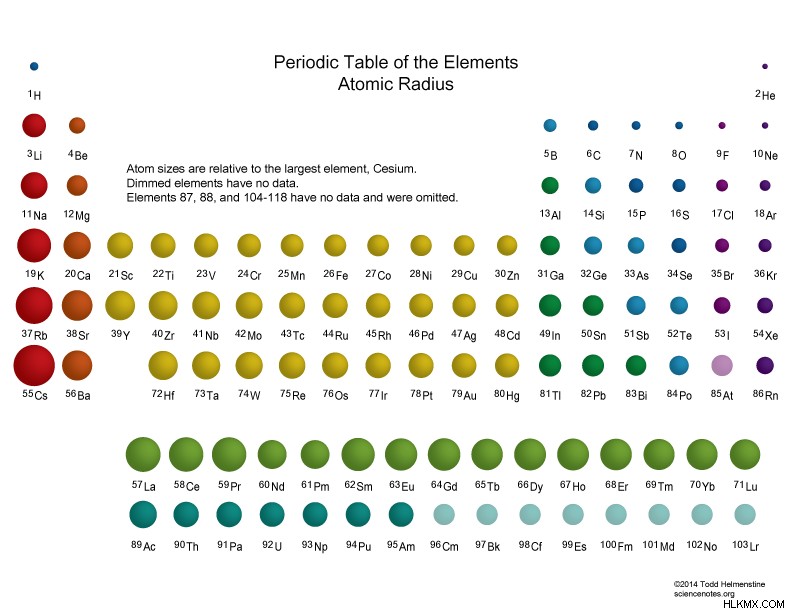
原子半径 は、中性原子の原子核の中心からその電子殻の外側境界までの平均距離です。孤立した中性原子の場合、原子核は 30 ピコメートル (1 兆分の 1 メートル) から 300 pm の範囲です。一番大きい原子はセシウム、一番小さい原子はヘリウムです。原子の大きさのほとんどは、その電子に由来します。原子半径は、原子核の半径 (1 ~ 10 フェムトメートル) の 10,000 倍以上です。別の言い方をすれば、原子半径は可視光の波長 (400 ~ 700 nm) の 1000 分の 1 未満です。
電子殻の端は明確に定義されていないため、リファレンスに応じて各原子の値が異なります。ただし、実際の数は、原子の相対的なサイズほど重要ではありません。
イオン半径
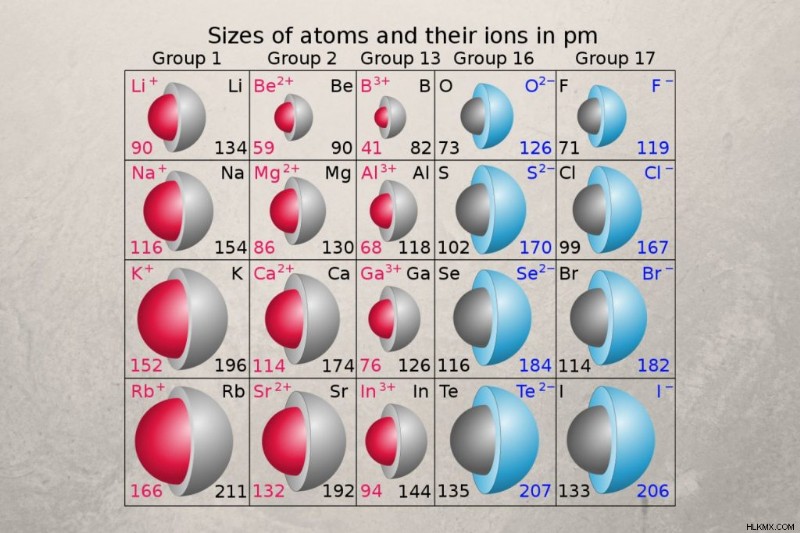
原子半径は中性原子のサイズを表しますが、イオン半径は 荷電原子の大きさを測定します。イオン半径は、イオン結晶内の元素の単原子イオンの半径、または結合した 2 つのガス原子間の距離の半分です。イオン半径の値は、午後 31 時から午後 200 時までの範囲です。
イオン半径は固定された特性ではないため、元素のイオンの値は条件によって異なります。配位数とスピン状態は、イオン半径の測定に影響を与える主な要因です。 X 線結晶構造解析により、経験的なイオン半径測定値が得られます。ポーリングは有効核電荷を使用してイオン半径を計算しました。イオン半径の表は通常、値を決定するために使用される方法を示します。
周期表の傾向
電子配置は周期表上の元素の構成を決定するため、原子半径とイオン半径は周期性を示します:
- 周期表のグループまたは列を下に移動すると、原子半径とイオン半径が増加します。これは、原子が電子殻を獲得するためです。
- 原子半径とイオン半径は、通常、周期表の周期または行を移動すると減少します。これは、陽子の数が増えると、電子を引き付ける力が強くなり、電子がより強く引き寄せられるためです。希ガスはこの傾向の例外です。希ガス原子のサイズは、それに先行するハロゲン原子よりも大きい。
原子半径とイオン半径
原子半径とイオン半径は、周期表で同じ傾向に従います。ただし、イオン半径は、電荷に応じて、元素の原子半径よりも大きい場合と小さい場合があります。イオン半径は負電荷で増加し、正電荷で減少します。
- 陽イオンまたは陽イオン :原子は、陽イオンを形成するときに 1 つまたは複数の電子を失い、イオンが中性原子よりも小さくなります。通常、金属は陽イオンを形成するため、イオン半径は原子半径よりも小さくなる傾向があります。
- 陰イオンまたはマイナスイオン :原子が 1 つ以上の電子を獲得して陰イオンを形成し、イオンを中性原子よりも大きくします。非金属は陰イオンを形成することが多いため、イオン半径は原子半径よりも大きくなる傾向があります。これはハロゲンで特に顕著です。
原子およびイオン半径の宿題の質問
生徒は、原子半径とイオン半径の差と周期表の傾向に基づいて、原子とイオンのサイズを並べ替えるように求められることがよくあります。
例:Rb、Rb、F、F、Te のようにサイズの大きい順に種をリストします
それらを並べ替えるために、原子とイオンのサイズを知る必要はありません。ルビジウム陽イオンは、イオンを形成するために電子を失う必要があったため、ルビジウム原子よりも小さいことがわかります。同時に、ルビジウムが電子を失ったときに電子殻を失ったことも知っています。フッ素陰イオンがフッ素原子よりも大きいのは、イオンを形成するために電子を獲得したためです。
次に、周期表を見て、元素の原子の相対的なサイズを決定します。中性テルルは中性ルビジウム原子よりも小さいのは、原子半径がピリオドを横切って移動するにつれて減少するためです。しかし、テルル原子は追加の電子殻を持っているため、ルビジウム陽イオンよりも大きい.
すべてをまとめる:
F
原子半径とイオン半径だけが、原子とイオンのサイズを測定する方法ではありません。状況によっては、共有結合半径、ファン デル ワールス半径、金属半径、およびボーア半径がより適切です。これは、原子のサイズがその化学結合挙動の影響を受けるためです。
等電子イオンは、同じ電子構造と同じ数の価電子を持つ異なる元素の陽イオンまたは陰イオンです。たとえば、K と Ca はどちらも [Ne]4s 電子配置を持っています。 S と P はどちらも、電子配置として 1s 2s 2p 3s 3p を持っています。等電子性は、さまざまな元素のイオン半径を比較し、電子の挙動に基づいてそれらの特性を予測するために使用できます。その他の原子半径測定
等電子イオン
参考文献