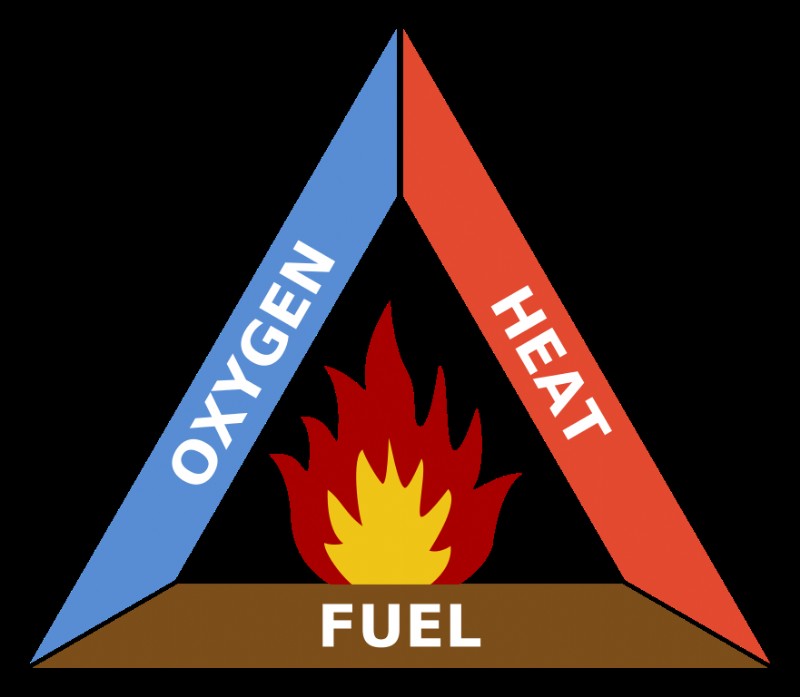
燃焼 反応は、燃料と酸化生成物を形成する酸化剤との間の発熱化学反応です。一般化学では、化学反応の主要なタイプの 1 つです。燃焼は、炭化水素燃料 (石炭、プロパン、木材、メタンなど) と分子状酸素 (O2 )、二酸化炭素 (CO2 )、水 (H2 O)、および熱。熱は、化学反応を開始するための活性化エネルギーを提供します。酸素、燃料、熱の組み合わせが火の三角形を形成します 、これは燃焼の要件を表す 1 つの方法です。
燃焼反応式の一般形
燃焼反応の一般的な形式は次のとおりです。
炭化水素 + 酸素 → 二酸化炭素 + 水 + 熱
Cx やあy + O2 → CO2 + H2 O
燃焼反応の例
燃焼は燃焼とも呼ばれます。したがって、考えられる燃焼の例はすべて燃焼反応であり、燃焼するマッチ、ろうそく、キャンプファイヤー、ガス バーナーなどがあります。燃焼反応の平衡方程式の例を次に示します:
- メタンの燃焼
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2 O(g) - ナフタレンの燃焼
C10 H8 + 12 O2 → 10 CO2 + 4 H2 ああ - エタンの燃焼
2C2 H6 + 7 O2 → 4 CO2 + 6 H2 ああ - ブタンの燃焼 (ライターによく見られる)
2C4 H10 (g) +13O2 (g) → 8CO2 (g) +10H2 O(g) - メタノール (木材アルコールとも呼ばれる) の燃焼
2CH3 OH(g) + 3O2 (g) → 2CO2 (g) + 4H2 O(g) - プロパンの燃焼 (ガスグリル、暖炉、一部の調理用コンロで使用)
2C3 H8 (g) + 7O2 (g) → 6CO2 (g) + 8H2 O(g)
燃焼反応の見分け方
炭化水素 (炭素と水素を含む分子) と酸素ガス (O2) を見ると、燃焼反応があることがわかります。 ) 反応矢印の反応物側 (左側) と二酸化炭素 (CO2 ) と水 (H2 O) 反応矢印の製品側 (右側)。また、酸素による燃焼は常に熱を発生します。反応を開始するにはまだ活性化エネルギーが必要ですが、開始時に吸収されるよりも多くの熱が燃焼によって放出されます。
多くの燃焼反応で炎が発生します。火が見えたら、それは燃焼反応を示しています。ただし、火がなくても燃焼が起こることがよくあります。たとえば、くすぶりは炎のない燃焼です。
反応物がそれ自体の酸化剤 (酸素) を含んでいたり、燃焼が不完全で二酸化炭素と水以外の生成物を生成したりするため、燃焼反応を認識するのが難しい場合があります。たとえば、一部のロケットはエアロジン 50 (C2 H12 N4 ) と四酸化窒素 (N2 O4 )。賢ければ、Aerozine 50 には燃料として機能するのに必要な化学結合 (炭素-水素および炭素-窒素) が含まれており、四酸化窒素が燃焼用の酸素を供給することがわかります。
次に、酸素さえ関与しない燃焼の形態があります。
無酸素燃焼
技術的には、酸化は常に酸素を必要とするわけではないため、酸素がなくても燃焼が発生する可能性があります.
酸化剤は、通常、化学反応に酸素を供給することによって電子を受け取ります。他の酸化剤には、ハロゲン(フッ素、塩素など)が含まれます。金属燃料は、酸素をまったく必要とせずに、フルオロポリマー (テフロン、バイトンなど) を使用して燃焼します。
完全燃焼と不完全燃焼
他の化学反応と同様に、燃焼は制限反応物質の影響を受け、常に完了するとは限りません。
- 完全燃焼 または「クリーン燃焼」は、炭化水素の酸化によって二酸化炭素と水のみが生成される場合に発生します。ろうそくのロウを燃やすことは、完全燃焼の良い例です。燃えている芯からの熱がワックス (炭化水素) を気化させます。ワックスは酸素と反応し、二酸化炭素と水を放出します。ワックスは燃え尽き、二酸化炭素と水は空気中に放散されます。
- 不完全燃焼 または「汚れた燃焼」は、不完全な炭化水素の酸化であり、二酸化炭素と水に加えて、一酸化炭素 (CO)、炭素 (すす)、およびその他の生成物を生成します。木材とほとんどの化石燃料は不完全燃焼し、これらの追加の廃棄物を放出します。
参考文献
- ラクナー、マクシミリアン。冬、フランツ。 Agarwal、Avinash K.、編。 (2010)。 燃焼ハンドブック .ワイリー-VCH。 ISBN 978-3-527-32449-1.
- Law, C.K. (2006)。 燃焼物理学 .ケンブリッジ大学出版局。 ISBN 9780521154215.
- Schmidt-Rohr, K (2015). 「燃焼が常に発熱性であり、O2 1 モルあたり約 418 kJ を生み出す理由 」。 J.化学。教育 . 92 (12):2094–2099. doi:10.1021/acs.jchemed.5b00333