モル比は、化学反応における反応物と生成物の固定比率を表します。これは化学量論において重要であり、特にモルからグラムへの変換の変換係数として使用される場合に重要です。以下は、モル比の定義と、比率を見つけて使用する方法を示す例です。
モル比の定義
モル比は、化学反応における任意の 2 つの物質間の比率です。これは、バランスの取れた化学式における 2 つの係数の比率です。モル比は、モル比またはモル対モル比としても知られています。
平衡方程式でモル比を求める
化学式の係数を使用して、化学反応の任意の 2 つのコンポーネント間のモル比を見つけます。係数は数式の前の数字です。
たとえば、水を作るための水素と酸素の反応式は次のとおりです。
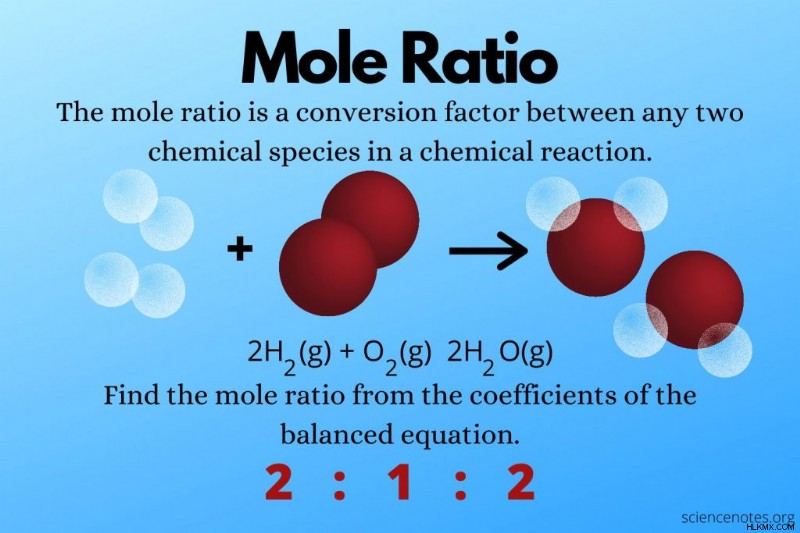
2 H2 (g) + O2 (g) → 2 H2 O(g)
水素の係数は 2 です。酸素の場合、1 を表す係数はありません。水の係数は 2 です。
水素と酸素のモル比は2:1です。酸素と水のモル比は1:2です。水素と水のモル比は 2:2 ですが、これを 1:1 に減らすことができます。
不均衡な式でモル比を求める
モル比を書くには、バランスの取れた式が必要です。不均衡な方程式を与えられた場合、バランスを取ることが最初のステップです。
たとえば、オゾンを酸素に変換する反応を考えてみましょう:
O3 → O2
この化学式は不均衡です。どうして知っていますか?バランスの取れた方程式は、反応矢印の両側に同じ数と種類の原子を持っています。与えられた式では、矢印の左側に 3 つの酸素原子があり、矢印の右側に 2 つの酸素原子があります。原子の数が両側で同じになるまで、反応物と生成物の前に係数を追加して、方程式のバランスを取ります。
バランスのとれた方程式は次のとおりです:
2O3 → 3O2
次に、係数を使用してモル比を取得します。この比率は、オゾン分子 2 つと酸素分子 3 つ、つまり 2:3 です。
モル比を使った問題例
比率は、2 つのものの関係を示す方法にすぎません。化学では、比率を使用して化学量論の問題を解決できることが重要です。
たとえば、4 モルのオゾンを反応させると、何モルの酸素が得られるかを求められたとします。これを解決する 1 つの方法は、同等の分数のような比率を設定することです:
オゾン 4 モル / 酸素 x モル =オゾン 2 モル / 酸素 3 モル
「x」を解く:
x 酸素モル =(オゾン 4 モル)*(酸素 3 モル)/オゾン 2 モル
x モル酸素 =6
オゾンのモルの「単位」が相殺され、酸素のモルが残ることに注意してください。あなたの仕事を再確認してください!この計算で学生が犯す最も一般的な間違いは、単位が相殺されないように分数を設定することです。
通常、グラム単位の値が表示され、グラム単位での回答を求められます。モル比は、グラムなどの質量単位では機能しません。したがって、代数と、グラムからモルおよびモルからグラムへの変換を行うことができます。これらすべてのスキルを組み合わせるには練習が必要です。
たとえば、0.2 グラムのオゾンを反応させると何グラムの酸素が得られるかを求めてください。
<オール>x モル =0.2 グラム * (1 モル/16.00 グラム) =0.0125 モル
酸素のモル =0.125 モルのオゾン * (3 モルの酸素/2 モルのオゾン)
酸素のモル =0.01875 モルの酸素ガス
酸素ガスのグラム =0.01875 モル * 16.00 グラム/モル
酸素ガスのグラム =0.3 グラム
この場合、化学式の両側で 1 種類の原子 (酸素) しか発生しないため、実際には数学を節約できたはずです。ただし、すべての手順に従うことをお勧めします。また、正しい有効数字を使用して回答を報告することを忘れないでください。
最後に、任意の反応物または生成物が与えられる可能性があり、同じ手法を使用して他の反応物または生成物の量を見つけることができることを認識してください.場合によっては、2 つの量があり、モル比を使用して制限反応物を見つけることがあります。
濃度の単位としてのモル比
化学量論では、モル比はバランスの取れた化学式における種のモル間の比ですが、モル比は一部の分野では濃度の単位でもあります。たとえば、大気化学では、モル比は対象成分のモル数を物質の総モル数で割った値です。
ri =ni / ntot
ここで、ri i のモル比 、 ni i のモル数 、および ntot 総モル数です。混乱を避けるために、濃度の単位はモル比ではなくモル分率と呼ばれることがあります。
参照
- IUPAC (1997) 化学用語集 (「ゴールドブック」)。 (第 2 版)。ブラックウェル科学出版物。 ISBN 0-9678550-9-8.