pOH と pH は、水溶液の酸性度または塩基性度を表す方法です。 pOH の定義、pOH と pH の関係、pOH の計算例を以下に示します。
pOH の定義
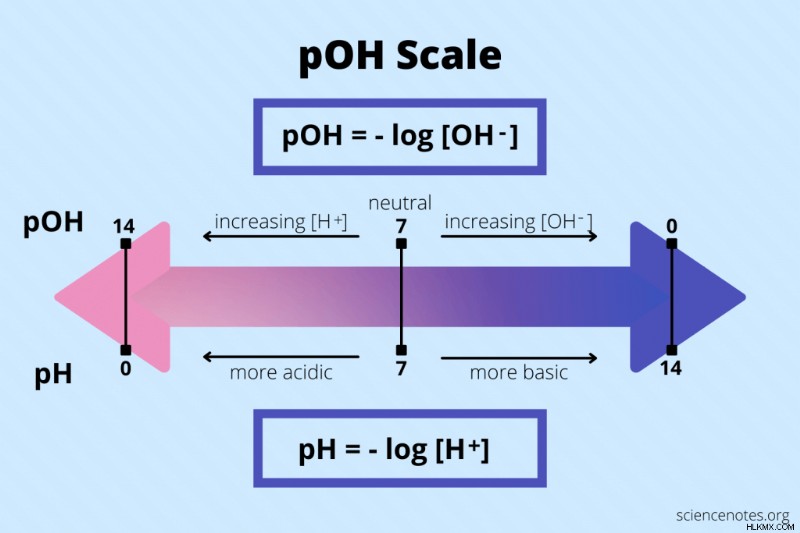
pOH 水溶液の は、水酸化物イオン (OH) 濃度の負の対数です。
pOH =-log[OH]
pH と同様に、pOH 値の範囲は 1 ~ 14 で、7 が中性です。 pH と pOH のスケールは互いに反対です。 pOH 値が低いほどアルカリ性の塩基性が高く、pOH 値が高いほど酸性度が高いことを示します。対照的に、低い pH は高い酸性度を示し、高い pH は高い塩基性を示します。
pOH を使用する理由
pH はすでに酸と塩基を表す便利な方法であるため、なぜ pOH を使用する必要があるのか 疑問に思うかもしれません。 pOH の主な用途は、溶液の pH がわかっている場合に水酸化物イオン濃度を求めることです。また、塩基の pOH を計算してからその pH を計算する方が簡単です。
pH と pOH の関係
pH と pOH は関連しています。 pH が上昇すると、pOH は低下します。 pH が低下すると、pOH が増加します。
- pH + pOH =14 (25° C)
- pH =14 – pOH
- pOH =14 – pH
pOH の調べ方
pOH を求める 2 つの方法は、水酸化物イオン濃度から、または既知の pH 値からです。
水酸化物イオン濃度から pOH を求める
塩基溶液のモル濃度がわかっている場合は、pOH 式の水酸化物イオン濃度として入力してください。
たとえば、0.25 M NaOH 溶液の pOH を求めます。
ここで重要なのは、水酸化ナトリウムが強塩基であることを認識することです。したがって、その濃度はその水酸化物イオン濃度です。これは、水酸化ナトリウムが水中でそのイオンに完全に解離するためです:
NaOH(aq ) → Na(aq )+OH(aq )
言い換えれば、NaOH 1 モルごとに、溶液中に 1 モルの OH が存在します。 NaOH と水酸化物イオンの濃度値は同じです:
[NaOH] =[OH]
したがって、単純に pOH 式の水酸化ナトリウム濃度を使用してください:
pOH =-log[OH]
pOH =-log(0.25)
pOH =0.60
答えを考えて、それが理にかなっているかどうかを考えてください。これは強塩基溶液であるため、pH 値が高いか、pOH 値が低いことが予想されます。 0.60 の pOH は非常に低いので、答えは理にかなっています!
酸の濃度がわかっている場合は、まず pH を計算し、その値を使用して pOH を求めます。
pH から pOH を求める
たとえば、pH 3.5 の溶液の pOH を求めます。
pH + pOH =14
pOH =14 – pH
pOH =14 – 3.5
pOH =10.5
参考文献
- コヴィントン、A.K.;ベイツ、RG。ダースト、R. A. (1985)。 「pH スケールの定義、標準参照値、pH の測定、および関連用語」。 Pure Appl.化学 . 57 (3):531–542。 doi:10.1351/pac198557030531
- フェルドマン、アイザック (1956)。 「pH測定の使用と乱用」。 分析化学 . 28 (12):1859–1866. doi:10.1021/ac60120a014
- Mendham, J.;デニー、RC。バーンズ、JD。 Thomas、M. J. K. (2000)。 フォーゲルの定量的化学分析 (第6版)。ニューヨーク:プレンティス・ホール。 ISBN 0-582-22628-7.