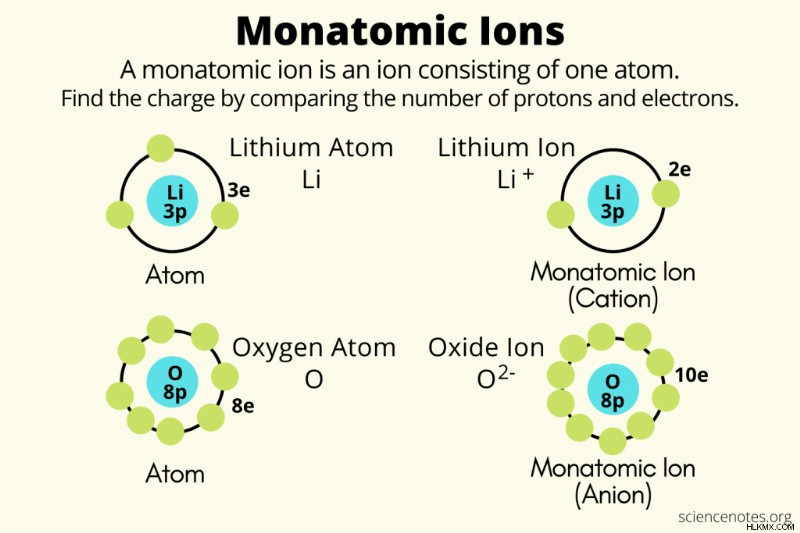
単原子イオン ちょうど1個の原子からできているイオンです。つまり、陽子と電子の数が等しくない原子です。電子よりも陽子の方が多い場合、イオンは正味の正電荷を持ち、陽イオンになります。陽子よりも電子が多い場合、イオンは正味の負電荷を持ち、陰イオンになります。通常、金属は単原子陽イオンを形成し、非金属は単原子陰イオンを形成します。
単原子イオン vs 多原子イオン
多原子イオンには、複数の原子が含まれています。これらの原子が同じ元素で構成されている場合でも同様です。たとえば、O2 は多原子イオン (より正確には、二原子イオン) です。
一部の辞書では、「単原子」を 1 つの kind を指すものとして定義していることに注意してください。 1つの原子ではなく、原子の。これは混乱を招く可能性があります!
単原子カチオンのリスト
一般的な単原子カチオンの例を次に示します。
| 名前 | シンボル |
|---|---|
| 水素 | H |
| リチウム | リー |
| ナトリウム | ナ |
| カリウム | K |
| ルビジウム | Rb |
| セシウム | Cs |
| マグネシウム | マグ |
| カルシウム | Ca |
| ストロンチウム | シニア |
| バリウム | バ |
| アルミニウム | アル |
| シルバー | 銀 |
| 亜鉛 | 亜鉛 |
| 鉄(II) | Fe |
| 鉄(III) | Fe |
| 銅(I) | Cu |
| 銅(II) | Cu |
| 鉛(II) | 鉛 |
アルカリ金属は +1 電荷を持つ陽イオンを形成し、アルカリ金属は +2 電荷を持つ陽イオンを形成することに注意してください。ほとんどの単原子イオンは金属ですが、メタロイドと非金属の単原子イオンもあります。
単原子陰イオンのリスト
非金属は、ほとんどの単原子陰イオンを形成します。水素は、単原子カチオンと単原子アニオンの両方を形成する元素の例です。以下は一般的な単原子陰イオンのリストです。
| 名前 | シンボル |
|---|---|
| 水素化物 | H |
| フッ化物 | F |
| 塩化物 | Cl |
| ブロマイド | Br |
| ヨウ化物 | 私 |
| 酸化物 | O |
| 硫化物 | S |
| 窒化物 | いいえ |
| リン化物 | P |
単原子イオンの命名方法
単原子陽イオンと単原子陰イオンでは命名規則が異なります。
単原子カチオンは元素名で表されます。名前には料金が含まれることがよくあります。これは、原子が複数の陽イオンを形成する場合に重要です。例えば、Hのことを話すときは「H plus or H plus one」とか「Hydrogen plus or Hydrogen plus one」などと呼びます。カルシウム単原子イオン (Ca) は、「Ca プラス 2」または「カルシウム プラス 2」です。複数の電荷が共通している場合、名前には原子の酸化状態が含まれます。たとえば、単原子銅イオンは、銅(I)またはCu(I)および銅(II)またはCu(II)です。
単原子陰イオンは通常、可変電荷を持たないため、命名は簡単です。名前は要素名の最初の部分で、その後に -ide サフィックスが続きます。したがって、H は水素化物、N は窒化物などです。
単原子イオンの形成方法
原子は、化学反応中、イオン化合物が融解するとき、および電解質が水中で解離するときに、自然に単原子イオンを形成します。たとえば、NaCl は水に溶けると単原子イオン Na と Cl- を形成します。原子はこの単原子イオンを形成するため、最も安定した電子配置になります。単原子イオンは、半分または完全に満たされた価電子殻を持つ傾向があります。
エネルギーを追加すると、単原子イオンも形成されます。分子内の原子間の結合を切断するか、電子を原子から解放します (イオン化します)。これらの単原子イオンは、反応性が高く、短命である可能性があります。
単原子イオン vs 単原子元素
はい、単原子イオンは元素のイオンです。ただし、単原子イオンと単原子元素という用語には異なる意味があります。
単原子元素は、電気的に中性の単一原子で構成される元素です。単原子元素のよく知られた例は、希ガス原子です。
参考文献
- シリスピー、チャールズ (ed.) (1970)。 科学伝記の辞書 (第 1 版)。ニューヨーク市:チャールズ・スクリブナーの息子。 ISBN 978-0-684-10112-5。
- Knoll、Glenn F. (1999)。放射線の検出と測定 (第 3 版)。ニューヨーク:ワイリー。 ISBN 978-0-471-07338-3.
- マスタートン、ウィリアム。ハーレー、セシル (2008)。 化学:原理と反応 .センゲージ学習。 ISBN 0-495-12671-3.







