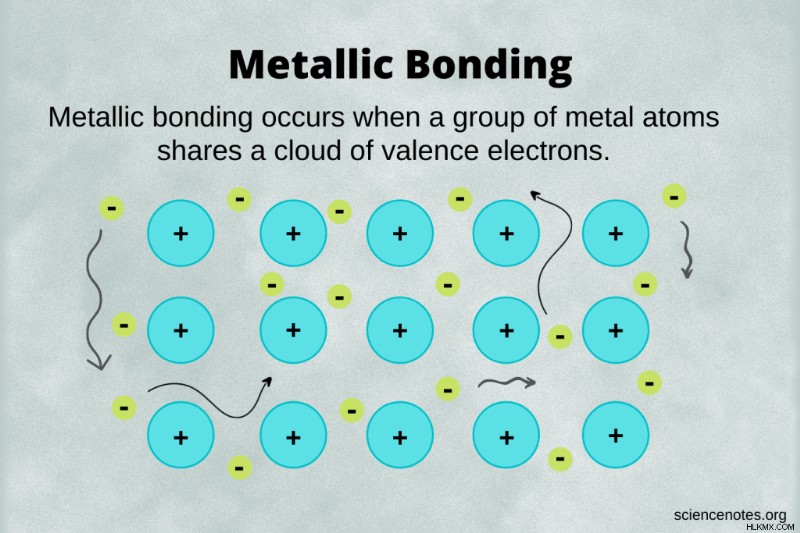
金属結合 金属核が自由な価電子を共有する化学結合の一種です。これらの自由電子は非局在と呼ばれます 1 つの原子に限定 (ローカライズ) されていないためです。対照的に、価電子は共有結合の 2 つの原子間で共有され、イオン結合の他の原子よりも 1 つの原子の近くで多くの時間を過ごします。
- 金属結合では、価電子は複数の原子間で非局在化または自由に流れます。
- イオン結合と共有結合には、原子が 2 つしか含まれていません
- 金属結合は、金属の主要な特性の多くを占めています。
電子海モデル
電子海モデルは、金属結合の単純化されたやや不正確なビューですが、視覚化するのが最も簡単です.このモデルでは、電子の海が金属陽イオンの格子の周りに浮かんでいます。
このモデルの主な問題は、金属またはメタロイド原子が実際にはイオンではないことです。たとえば、金属ナトリウムの塊がある場合、それは Na イオンではなく Na 原子で構成されています。電子は原子核の周りをランダムに浮遊しているわけではありません。むしろ、原子の電子配置を満たす電子は、その原子またはその隣の原子から来ます。場合によっては、電子が原子核のクラスターの周りを浮遊します。共有結合の共鳴構造によく似ています。
金属結合の形成方法
共有結合と同様に、金属結合は電気陰性度が類似した 2 つの原子間に形成されます。金属結合を形成する原子は、金属と一部の半金属です。たとえば、金属結合は、銀、金、真鍮、および青銅で発生します。これは、加圧水素と炭素同素体グラフェンにおける結合のタイプでもあります。
金属結合を機能させるのは、正に帯電した原子核に関連する価電子軌道が互いに重なり合うことです。ほとんどの場合、これには が含まれます と p 軌道。金属原子は、正の原子核と非局在化した電子の間の引力によって互いに結合しています。
金属によって形成される結合
金属原子は非金属とイオン結合を形成します。それらは、それ自体または他の金属と共有結合または金属結合を形成します。特に水素とアルカリ金属は、共有結合と金属結合の両方を形成します。それで、金属水素とリチウムが発生します。 H2もそう と Li2 ガス分子。
宿題の質問における金属結合
形成される絆の種類
最も一般的な宿題の質問は、2 つの原子が金属結合、イオン結合、または共有結合を形成するかどうかを尋ねます。原子が両方とも金属である場合、原子は金属結合を形成します。特定の状況では共有結合を形成することもありますが、1 つのタイプの結合を選択する必要がある場合は、金属を選択します。イオン結合は、電気陰性度が大きく異なる原子間 (通常は金属と非金属の間) で形成されます。共有結合は通常、2 つの非金属間で形成されます。
プロパティの予測
金属結合を使用して、金属要素の特性を比較できます。たとえば、マグネシウムの融点がナトリウムよりも高い理由は、金属結合によって説明されます。融点が高い元素ほど、化学結合が強くなります。
原子の電子配置を調べて、どの元素がより強い結合を形成するかを決定します:
ナトリウム:[Ne]3s
マグネシウム:[Ne]3s
ナトリウムは1つの価電子を持っていますが、マグネシウムは2つの価電子を持っています.これらは、金属結合で非局在化した電子です。したがって、マグネシウム原子の周りの電子の「海」は、ナトリウム原子の周りの海の 2 倍の大きさです。
両方の原子で、価電子は同じ数の電子殻 ([Ne] コアまたは 1s 2s 2p) によって遮蔽されます。各マグネシウム原子はナトリウム原子よりも陽子が 1 つ多いため、マグネシウム原子核は価電子に対してより強い引力を発揮します。
最後に、原子核と電子の間の引力が大きいため、マグネシウム原子はナトリウム原子よりわずかに小さいです。
これらすべての考慮事項をまとめると、マグネシウムがより強力な金属結合を形成し、ナトリウムよりも高い融点を持つことは当然のことです.
金属結合と金属特性
金属結合は、金属に関連する特性の多くを占めています。
- 高い電気伝導性と熱伝導性 :自由電子は、電気伝導における電荷の運搬と、熱伝導における熱エネルギー (熱) の運搬です。
- 融点と沸点が高い :非局在電子と原子核の間の強い引力により、金属の融点と沸点が高くなります。
- 可鍛性と延性 :金属結合は、可鍛性や延性などの金属の機械的特性を説明します。電子は互いにすり抜けるため、金属をハンマーで叩いてシートにし (展性)、ワイヤに引き寄せる (延性) ことができます。
- 金属光沢 :非局在化した電子がほとんどの光を反射し、金属に光沢のある外観を与えます。
- シルバー色 :ほとんどの金属が銀色に見えるのは、ほとんどの光が振動する共鳴電子 (表面プラズモン) から反射されるためです。吸収された光は、可視範囲外のスペクトルの紫外部分にある傾向があります。銅と金では、吸収された光は可視範囲内にあるため、これらの金属は赤みがかった黄色がかった色になります。
金属結合の強度は?
金属結合は、非常に強いものから弱いものまでさまざまです。その強さは、電子殻が価電子を核の引力からどれだけ遮蔽するかに大きく依存します。これは部分的には大きな原子の相対論的効果によるもので、水銀とランタニドの金属結合は軽い遷移金属よりも弱い.
金属結合、イオン結合、共有結合の相対的な強さについて一般化するには、個人差が多すぎます。
参考文献
- ブリューワー、スコット H.;フランゼン、ステファン(2002)。 「反射FTIR分光法によって決定されるシート抵抗および表面吸着層に対するインジウムスズ酸化物プラズマ周波数依存性」。 The Journal of Physical Chemistry B . 106 (50):12986–12992。 doi:10.1021/jp026600x
- Daw, Murray S.;フォイルズ、スティーブン・M。バスクス、マイケル I. (1993)。 「埋め込み原子法:理論と応用のレビュー」. マテリアル サイエンス レポート . 9 (7–8):251–310. doi:10.1016/0920-2307(93)90001-U
- 奥村 K. &テンプルトン I. M. (1965). 「セシウムのフェルミ面」。 ロンドン王立協会の議事録 . 287 (1408):89–104. doi:10.1098/rspa.1965.0170
- ポーリング、ライナス (1960)。 化学結合の性質 .コーネル大学出版局。 ISBN 978-0-8014-0333-0。
- Rioux, F. (2001). 「H2 の共有結合 」。 化学教育者 . 6 (5):288–290。 doi:10.1007/s00897010509a