二酸化炭素の混成を決定するために、まず炭素原子を取りましょう。炭素の原子は、2 つの二重結合から構成されています。つまり、2 つの有効なペアが存在します。ただし、これは酸素を含む結合を作成するには十分ではありません。したがって、2s 軌道から 1 個の電子が 2s 準位から 2p 準位にシフトし、2 つの混成軌道が作成されます。炭素原子に属するこれらの混成 sp 軌道は、2 つのシグマ結合を作成するために、酸素原子に属する 2p 軌道を超えて拡張します。残った 2 つの p 電子の間に pi 結合が形成されます。
酸素は、CO2 分子内に sp2 の 3 つのハイブリッド軌道を作成するためにその軌道をハイブリッド化しました。さらに、酸素原子内のp軌道は同じままで、主にパイ結合を作成するために使用されます.ただし、これら 3 つの sp 混成軌道のうち 1 つの sp 混成軌道のみが炭素原子との結合に使用されます。
ハイブリダイゼーションの計算
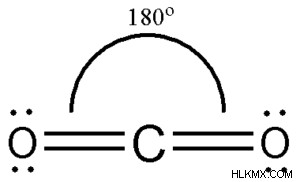
まず、分子の化学構造を作って分子内の結合の種類を調べましょう。特に、各原子が作る単結合、二重結合、三重結合の数を書き留めます。たとえば、CO2 の O 分子は 2 つの二重結合で構成されています。分子は、O =C =O の形式で表すことができます。ここで、酸素のすべての原子が中心の炭素と二重結合を作ります。
ハイブリダイゼーションは sp 軌道で定義されます。アルファベットの「s」と「p」は、電子が移動する軌道経路の形状を示すのに役立ちます。 「s」軌道の場合、軌道はほぼ円形です。 「p」軌道の場合、パスの形状はダンベルのように見え、円軌道ではなく 2 つの領域のうちの 1 つに主に存在する電子を含みます。
次に、既存の結合の種類を利用して、各原子の混成を決定します。二重結合がないことは、sp3 のハイブリダイゼーションを表します。単結合を有する原子は、sp2のハイブリダイゼーションを含む。 2 つ以上の二重結合を持つ原子、または単一の三重結合を持つ原子は、sp.
の混成を構成します。CO2 の炭素原子には 2 つの二重結合があり、1 つは酸素の各原子を持っています。したがって、炭素の混成はspです。 CO2 のすべての酸素原子には、炭素との二重結合が 1 つ付いています。さらに、各水素の混成は sp2 です。分子の全体的なハイブリダイゼーションは、中心原子のハイブリダイゼーションを見つけることによって決定する必要があります。 CO2 では、炭素は中心にある原子です。これは、炭素が sp 混成を持っているためです。したがって、分子の全体的なハイブリダイゼーションは sp.
CO2 の性質
CO2 には sp タイプの交配があります。このタイプのハイブリダイゼーションは、炭素が他の 2 つの原子と結合した結果として起こります。結合は、1 つの単結合 + 1 つの三重結合または 2 つの二重結合である可能性があります。また、CO2 のすべての原子を観察することで、密接に見つけることができます。
CO2 における炭素の混成
炭素の電子配置は、基底状態で 1s2 2s2 2p2 です。 2s 電子からの電子の 1 つは、1s2 2s1 2p3 の構成を与えるために、他の満たされていない 2p 軌道を埋めようとしていると見なすことができます。すべての 2p 軌道、2px、2pz、2py は、1 つの電子を保持します。 2s軌道と2p軌道の1つは、2pyが混成して2-sp混成軌道を作る可能性があると仮定しています。酸素には、基底状態に属する電子の 1s2 2s2 2p4 構成があります。
2px と 2pz などの 2 つの 2p 軌道は、1 つの電子だけを保持します。さらに、2px は、炭素からこれらの sp ハイブリッドの 1 つを超えて拡張し、結果として「σ」結合を作成できるようになりました。 2pz は、炭素上のハイブリダイズしていない 2-pz を超えて拡張し、π 結合を形成する可能性があります。同じプロセスが炭素の異なる側で発生し、すべての単一原子の 2-py 軌道と別の「π」結合を作成し、酸素の 2pz と「σ」結合を作成します。
結論
二酸化炭素の混成は、CO2 の混成を見つける方法を結論付けます。それは、二酸化炭素の混成に追加される複数の反応のさまざまな結果と結果を伝えます。さらに、ハイブリダイゼーションの計算プロセスも、トピックの理解を深めるために、この二酸化炭素ノートのハイブリダイゼーションで定義されています。さらに、この記事では CO2 の特性について説明します。