エントロピーは物理学と化学の重要な概念であり、宇宙論、生物学、経済学などの他の分野にも応用されています。物理学では、それは熱力学の一部です。化学では、物理化学の一部です。エントロピーの定義、いくつかの重要な公式、およびエントロピーの例をご覧ください。
- エントロピーは、システムのランダム性または無秩序の尺度です。
- 記号は大文字の S です。一般的な単位はジュール/ケルビン (J/K) です。
- エントロピーの変化は、正の値 (乱れが多い) または負の値 (乱れが少ない) を持つことができます。
- 自然界では、エントロピーが増加する傾向があります。熱力学の第 2 法則によると、システムのエントロピーは、別のシステムのエントロピーが増加した場合にのみ減少します。
エントロピーの定義
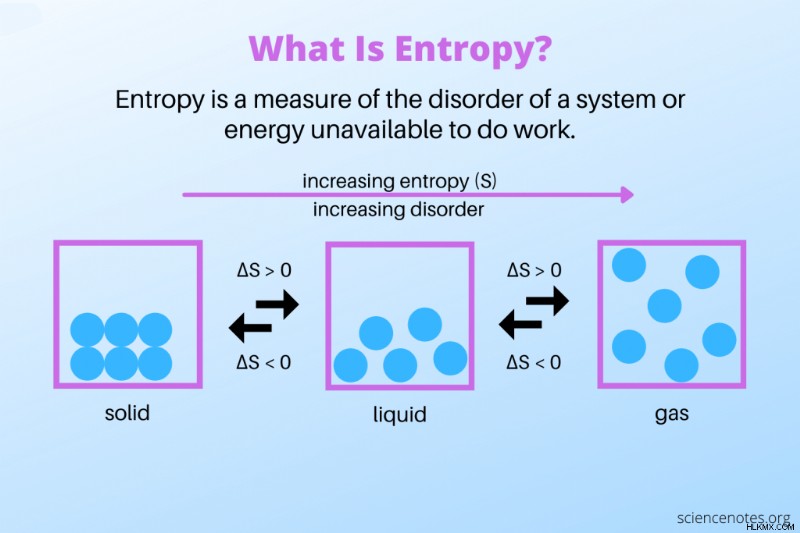
簡単な定義は、エントロピーはシステムの無秩序の尺度であるということです。秩序だった系はエントロピーが低く、無秩序な系はエントロピーが高い。物理学者は、エントロピーが作業を行うために利用できない閉じたシステムのエネルギーである場合、定義を少し異なる方法で述べることがよくあります.
エントロピーは熱力学系の広範な特性であり、存在する物質の量に依存することを意味します。方程式では、エントロピーの記号は文字 S です。これには、ケルビンあたりのジュール (J⋅K) または kg⋅m⋅s⋅K の SI 単位があります。
エントロピーの例
エントロピーの例をいくつか示します:
- 一般的な例として、クリーンルームと散らかった部屋の違いを考えてみましょう。クリーンルームはエントロピーが低い。すべてのオブジェクトはその場所にあります。散らかった部屋は無秩序でエントロピーが高い。散らかった部屋をきれいな部屋に変えるには、エネルギーを投入する必要があります。悲しいことに、それは決して自分自身をきれいにすることはありません.
- 溶解するとエントロピーが増加します。固体は、秩序だった状態からより無秩序な状態になります。たとえば、砂糖をコーヒーに混ぜると、砂糖の分子がまとまりにくくなるため、システムのエネルギーが増加します。
- 拡散と浸透もエントロピー増加の例です。分子は、平衡に達するまで、自然に高濃度の領域から低濃度の領域に移動します。たとえば、部屋の隅に香水をスプレーすると、最終的にはどこでも香りがします。しかし、その後、香りが自発的にボトルに戻ることはありません。
- 物質の状態間の相変化には、エントロピーの増加の例もあれば、エントロピーの減少を示すものもあります。氷のブロックは、固体から液体に溶けるにつれてエントロピーが増加します。氷は、結晶格子で互いに結合した水分子で構成されています。氷が溶けるにつれて、分子はより多くのエネルギーを獲得し、さらに離れて広がり、構造を失って液体を形成します。同様に、水から蒸気へのように、液体から気体への相変化は、システムのエネルギーを増加させます。気体を液体に凝縮したり、液体を気体に凍結したりすると、物質のエントロピーが減少します。分子は運動エネルギーを失い、より組織化された構造をとります。
エントロピー方程式と計算
いくつかのエントロピー式があります:
可逆過程のエントロピー
可逆プロセスのエントロピーの計算では、プロセス内の各構成が同じ確率であると仮定します (実際にはそうではない可能性があります)。結果の確率が等しいとすると、エントロピーはボルツマン定数 (kB ) 可能な状態の数の自然対数 (W) を掛けます:
S =kB で W
等温過程のエントロピー
等温過程の場合、エントロピーの変化 (ΔS ) は熱の変化 (ΔQ) に等しい ) を絶対温度 (T) で割った値 ):
ΔS = ΔQ / T
微積分を適用すると、エントロピーは dQ の積分です /T 初期状態から最終状態まで、ここで Q 熱とTです システムの絶対 (ケルビン) 温度です。
エントロピーと内部エネルギー
物理化学と熱力学では、エントロピーをシステムの内部エネルギー (U) に関連付ける 1 つの有用なエントロピー式があります。
dU =T dS – p dV
ここで、内部エネルギーの変化 dU 絶対温度に等しい T エントロピーの変化から外圧を引いたものを掛ける p 音量の変化 V .
エントロピーと熱力学第二法則
熱力学の第 2 法則は、閉じた系の全エントロピーは減少できないと述べています。たとえば、散らばった書類の山が自然にきれいな山になることは決してありません。キャンプファイヤーの熱、ガス、灰が自発的に再集合して木になることはありません。
ただし、1 つのシステムのエントロピーは できます 別のシステムのエントロピーを上げることで減少します。たとえば、液体の水を氷に凍らせると、水のエントロピーは減少しますが、相変化によってエネルギーが熱として放出されるため、周囲のエントロピーは増加します。物質は閉じた系ではないので、熱力学第二法則に違反することはありません。研究対象のシステムのエントロピーが減少すると、環境のエントロピーが増加します。
エントロピーと時間
物理学者や宇宙論者は、エントロピーを「時間の矢」と呼ぶことがよくあります。これは、孤立したシステム内の物質が秩序から無秩序へと移動する傾向があるためです。宇宙全体を見ると、そのエントロピーは増大します。時間が経つにつれて、秩序だったシステムはより無秩序になり、エネルギーが変化し、最終的には熱として失われます。
宇宙のエントロピーと熱死
一部の科学者は、宇宙のエントロピーが最終的に増加し、有用な作業が不可能になると予測しています。熱エネルギーだけが残ると宇宙は熱死します。しかし、他の科学者は熱死説に異議を唱えています。別の理論では、宇宙をより大きなシステムの一部と見なしています。
ソース
- アトキンス、ピーター。フリオ・デ・パウラ (2006)。 物理化学 (第8版)。オックスフォード大学出版局。 ISBN 978-0-19-870072-2.
- チャン、レイモンド (1998)。 化学 (第6版)。ニューヨーク:マグロウヒル。 ISBN 978-0-07-115221-1.
- クラウス、ルドルフ (1850)。 熱の原動力と、そこから導き出される熱の理論 .ポーゲンドルフの Annalender der Physick 、LXXIX(ドーバー復刻版)。 ISBN 978-0-486-59065-3.
- Landsberg、P.T. (1984)。 「エントロピーと「秩序」は一緒に増加することができますか?」. 物理文字 . 102A (4):171–173. doi:10.1016/0375-9601(84)90934-4
- ワトソン J.R.; Carson, E.M. (2002 年 5 月)。 「学部生のエントロピーとギブズ自由エネルギーの理解」 大学の化学教育 . 6 (1):4. ISSN 1369-5614