
理想気体の法則は、未知の気体の正体を決定するために使用できます。未知のガスの圧力、体積、および温度が与えられている場合、そのガスが何で構成されている可能性が高いかを判断できます。この理想気体の法則の例の問題は、このタスクを達成するために必要な手順を示しています。
ガス法の問題
X2 の 276.58 g のサンプル (g) 3.2気圧、27°Cで30.0 Lの容積があります。元素Xとは?
解決策
理想気体の法則は次の式で表されます
PV =nRT
どこ
P =圧力
V =ボリューム
n =ガス粒子のモル数
T =ケルビン単位の絶対温度
と
R はガス定数です。
気体定数 R は定数ですが、圧力と体積の測定に使用される単位によって異なります。単位に応じた R の値を次に示します。
R =0.0821 liter・atm/mol・K
R =8.3145 J/mol・K
R =8.2057 m・atm/mol・K
R =62.3637 L·Torr/mol·K または L·mmHg/mol·K
理想気体の法則の問題の最初のステップは、温度が絶対温度スケールにあることを確認することです。これは多くの学生にとって一般的なエラーの原因であり、開始したらすぐに解決することをお勧めします。
この例の温度は 27°C です。これをケルビンに変換するには、式を使用してください
K =°C + 273
K =27℃ + 273
K =300 K
では、この例に適したガス定数の値を選択してみましょう。この例ではリットルと大気を使用しているため、使用する必要がある R の値は
R =0.0821 liter·atm/mol·K
これで、理想気体の法則を使用して気体サンプルのモル数を求めるために必要なすべてが揃いました。 n 利回りの方程式を解く
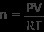
私たちの価値観を取り入れてください

n =3.9 モル
これで、系内に未知のガスが 3.9 モルあることがわかりました。また、これらの 3.9 モルの質量は 276.58 グラムであることもわかっています。では、気体 1 モルの重さを求めてください。
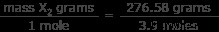
X2 のモル質量 =70.9 グラム/モル
X2 は、ガスが元素 X の 2 つの原子の二原子または堆肥であることを意味します。これは、X の原子量が X2 の値の半分になることを意味します。 のモル質量。
X の原子量 =½(70.9 グラム/モル)
X の原子量 =35.45 グラム/モル
周期表を見ると、原子量が 35.45 グラム/モルに最も近い元素は塩素です。
答え
元素 X の正体は塩素です。
このタイプの問題で注目すべき重要な点は、絶対温度、気体定数 R の単位、および未知の気体の 1 つの原子の原子質量です。理想気体の法則の問題は、摂氏や華氏などの相対温度ではなく、絶対スケール温度で常に機能するはずです。ガス定数の単位は、使用している単位と一致する必要があります。そうしないと、相殺されません。注意を払えば、これは簡単に回避できるエラーです。この問題には未知数として二原子ガスがありました。この手順を覚えていなければ、1 モルのガスの質量は 70.9 グラムであると考え、ガスがガリウム (69.72 g/モル) であると判断したことでしょう。







