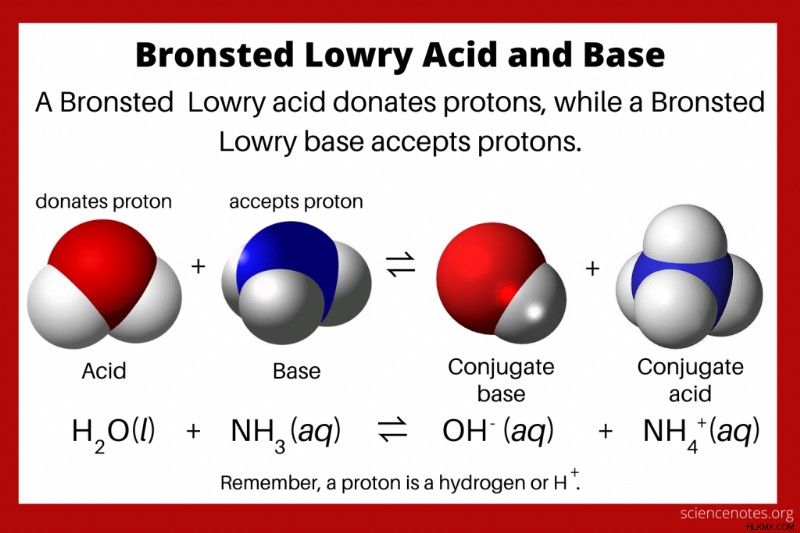
ブレンステッド ローリーの酸塩基理論 酸はプロトン (水素イオン、H+) を供与し、塩基はプロトンを受け取ると述べています。この反応により、酸の共役塩基と塩基の共役酸が形成されます。この理論の他の名前は、Brønsted–Lowry 理論です。 または 酸と塩基のプロトン理論 . Johannes Nicolaus Brønsted と Thomas Martin Lowry は、酸と塩基のアレニウス理論の一般化として、1923 年に独自に理論を概説しました。
- ブレンステッド・ローリー理論 酸を陽子供与体、塩基を陽子受容体と定義しています。
- プロトンは本質的に H イオンであるため、すべてのブレンステッド ローリー酸には水素が含まれています。
- 酸と塩基は共役対として存在します。酸がプロトンを供与すると、その共役塩基が形成されます。塩基がプロトンを受け取ると、その共役酸を形成します。
- 一部の化合物は、反応に応じて、酸または塩基として作用します。酸と塩基の両方である化合物は両性です。
ブレンステッド ローリー酸と塩基の定義
ブレンステッド・ローリー理論によれば、酸は陽子供与体です。プロトンは本質的に H イオンであるため、すべてのブレンステッド-ローリー酸には水素が含まれています。塩基はプロトン受容体です。酸がプロトンを供与すると、その共役塩基になります。塩基がプロトンを受け取ると、その共役酸を形成します。両性化合物は、プロトンを供与または受容できる種です。
たとえば、塩酸 (HCl) とアンモニア (NH
HCl(aq) + NH3 (aq) → NH4 (aq) + Cl(aq)
この反応では、HCl が NH3 に水素を供与します。 . HCl はブレンステッド ローリー酸であり、NH3 ブレンステッド・ローリー基地です。 HCl がそのプロトンを供与すると、その共役塩基 Cl を形成します。 NH3のとき プロトンを受け取り、その共役酸 NH4 を形成します .したがって、反応には 2 つの共役ペアが含まれます:
- HCl (酸) と Cl (共役塩基)
- NH3 (ベース) と NH4 (共役酸)
強および弱ブレンステッド ローリー酸と塩基
酸または塩基は強弱のいずれかです。
強酸または強塩基は、溶媒 (通常は水) 中でイオンに完全に解離します。強酸はすべて共役塩基に変換され、強塩基はすべて共役酸に変換されます。強酸の共役塩基は非常に弱い塩基です。強塩基の共役酸は非常に弱い酸です。強いブレンステッド ローリー酸の例には、塩酸 (HCl)、硝酸 (HNO
弱酸または弱塩基は不完全に解離し、弱酸とその共役塩基または弱塩基とその共役酸の両方が溶液中に残る平衡状態に達します。ブレンステッド・ロウリー酸の例としては、リン酸 (H3 PO4 )、亜硝酸 (HNO2 )、および酢酸 (CH3 COOH)。弱塩基の例には、アンモニア (NH3 )、水酸化銅 (Cu(OH)2 )、およびメチルアミン (CH₃NH₂)。
水は両性であり、一部の反応では酸として機能し、他の反応では塩基として機能することを覚えておいてください.強酸を水に溶かすと、水は塩基として働きます。強塩基を水に溶かすと、水は酸として働きます。
例:
HCl(aq) + H2 O(l) → H3 O(aq) + Cl(aq)
共役ペアは次のとおりです:
- HCl (酸) と Cl- (共役塩基)
- H2 O (ベース) と H3 O(共役酸)
NaOH(s) + H2 O(l) → Na(aq) + OH(aq)
共役ペアは次のとおりです:
- NaOH (塩基) と Na (共役酸)
- H2 O (酸) と OH (共役塩基)

pH の調べ方
酸の pH は 7 未満ですが、塩基の pH は 7 を超えています。値を見つける方法は次のとおりです。
アレニウス酸および塩基との比較
ブロンステッド・ローリー理論は、酸と塩基のアレニウス理論よりも制限が緩い。一つには、水以外の溶媒を使用できます。もう 1 つの違いは、酸と塩基の特性の定義に関するものです。アレニウス理論によれば、酸は水中の水素イオン (H) 濃度を増加させ、塩基は水中の水酸化物イオン (OH) 濃度を増加させます。ブレンステッド・ローリー理論では、OH を含まないか、少なくとも水中でそのイオンを形成しない塩基が考慮されます。たとえば、アンモニア (NH3 ) は、OH を含まないにもかかわらず、水中の水酸化物イオンの濃度を増加させるため、アレニウス塩基です。アンモニアは、ブレンステッド・ローリーの基地でもあります。ただし、メチルアミン (CH3NH2) はブレンステッド ローリー塩基ですが、アレニウス塩基ではありません。水酸化物を含まず、水中のイオン濃度を上げません。
ほとんどの場合、アレニウス酸とブロンステッド ローリー酸のリストは同じですが、例外があります。たとえば、ジメチルアミン [(CH3 )2 NH] は pKa 値が水よりも低いため、決してアレニウス酸ではありません。 HまたはH3を増加させません 水中のO濃度。通常はブレンステッド ローリー塩基ですが、ブレンステッド ローリー酸の場合もあります。ジメチルアミンは、ブチルリチウム (C4 H9 リー)
ルイス酸および塩基との比較
ギルバート・ルイスは、ブレンステッドとローリーが理論を発表したのと同じ年に、酸と塩基のルイス理論を提案しました。 2 つの理論の大きな違いは、Bronsted Lowry 理論が陽子を扱っているのに対し、Lewis 理論は電子に焦点を当てていることです。ルイス理論によれば、酸は電子対の受容体であり、塩基は電子対の供与体です。どちらの理論にも共役酸と塩基が含まれます。
すべてのブレンステッド ローリー酸はルイス酸ですが、すべてのルイス酸がブレンステッド ローリー酸であるとは限りません。ルイス理論では、水素原子を含まない酸が考慮されます。たとえば、BF3 および AlCl3 はルイス酸ですが、ブレンステッド ローリー酸ではありません。
参考文献
- Brönsted, J.N. (1923). 「Einige Bemerkungen über den Begriff der Säuren und Basen」[酸と塩基の概念に関する観察]。 Recuil des Travaux Chimiques des Pays-Bas . 42 (8):718–728. doi:10.1002/recl.19230420815
- ホール、ノリス F. (1940 年 3 月)。 「酸と塩基のシステム」。 Journal of Chemical Education . 17 (3):124–128. doi:10.1021/ed017p124
- Lowry, T. M. (1923). 「水素の特異性」。 化学工業協会誌 . 42 (3):43–47. doi:10.1002/jctb.5000420302
- マスタートン、ウィリアム。ハーレー、セシル。ネス、エドワード(2011)。 化学:原理と反応 .センゲージ学習。 ISBN 978-1-133-38694-0.
- マイヤーズ、リチャード (2003)。 化学の基礎 .グリーンウッド出版グループ. ISBN 978-0-313-31664-7.







