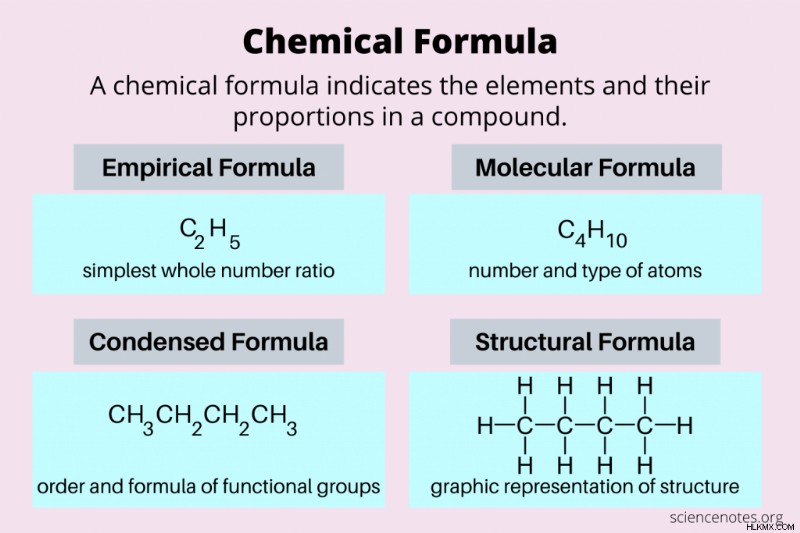
化学式 分子内の原子の数と種類を示す表記法です。つまり、立体物を文字で表現したものです。化学式の書き方にはいくつかの方法があります。一般に、式には、分子内の原子の種類を識別する元素記号が含まれています。ほとんどの式では、元素記号に続く添字はその元素の原子数を示します。
ここでは、化学式の最も一般的なタイプを見てみましょう:実験式、分子式、凝縮式、および構造式です。
| 化学式 | 説明 | 例 (ブタン) |
|---|---|---|
| 経験式 | 要素の最も単純な整数比 | C2 H5 |
| 分子式 | 実際の分子の原子の数と種類 | C4 H10 |
| 構造式 | 三次元構造の二次元表現 | CH3 CH2 CH2 CH3 |
化学式の一部
- 元素記号 :各元素に 1 文字または 2 文字の記号を書きます。たとえば、水素の記号は H です。金の記号は Au です。
- シンボルの順序 :慣例により、分子の陽イオンまたは正の部分が最初に続き、分子の陰イオンまたは負の部分が続きます。たとえば、H2 と書きます。 O2 の代わりに O H.
- 係数 :係数は式の前に書かれた数字です。存在する場合は、分子の数を示します。
- 下付き :下付き文字は、元素記号の後に書かれ、その元素の原子数を示す数字です。たとえば、H2 の「2」 O は、各水分子が 2 つの水素原子を持っていることを意味します。数字の「1」は書かれていません。つまり、各水分子には 1 つの酸素原子が含まれています。
- 上付き :上付き文字は、式の上とその右側に書かれた数字です。正味の電荷を示します。単発の場合は番号を省略します。たとえば、OH ではなく OH と書きます。存在する場合、番号は料金の前に表示されます。たとえば、SO4 と書きます。 .
経験式
経験式 分子内の要素の最小の整数比を示します。経験式の別名は、最も単純な式です。実験式は分子内に各元素の原子数を正確に示すものではありませんが、元素のモル比を示しています。
分子式
分子式は、ほとんどの人が化学式について話すときに意味するものです。これは、化学式を書いたり、化学物質を注文したりするときに使用する式です。 分子式 分子内の原子の数と種類を示します。実験式と分子式が同じ場合もあります。たとえば、H2 O は、水の経験的式と分子式の両方です。複雑な分子では、経験的式と分子式が異なることがよくあります。たとえば、ブタンの実験式は C2 です。 H5 、分子式はC4 H10 .分子式の下付き文字は、常に実験式の下付き文字の倍数です。
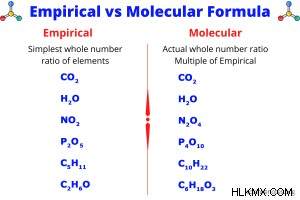
実験式と分子式の比較
これらの式を化学計算でどのように使用するかをご覧ください。
凝縮されたフォーミュラ
凝縮された式 分子内の官能基を表す構造式の一種。分子式と同様に、原子の正体と数の両方が含まれます。たとえば、ブタンの縮合式は CH3 です。 CH2 CH2 CH3 .式を見るだけで、水素原子が結合した炭素原子の鎖があることがわかります.
同一のグループを折りたたむ、短縮された式の短いバージョンもあります。たとえば、ブタンの同じ式を CH3 と書くことができます (CH2 )2 CH3 .これは、ポリマーやその他の大きな分子を記述するのに便利です。
構造式
構造式 は、3 次元分子の 2 次元グラフィック表現です。つまり、これは描画はできるがキーボードで入力できない数式のようなものです。例外は、官能基の位置を示す一種の構造式である縮約式です。
複数の種類の構造式があります:
- 要約式
- ルイスドット構造
- 骨格式
- ニューマン図法
- ノコギリ図法
- ハワース図法
- フィッシャー図法
構造式は要素記号を使用しますが、添え字を含む場合と含まない場合があります。骨格式では、線とそれらの接続方法が炭素原子と水素原子を示しているため、ほとんどの元素記号さえ省略されています。
すべての構造式には、対応する経験的および分子式があります。ただし、ほとんどの化学者は化学反応を説明するときに構造式を使用します。これは、プロセスを視覚化するのが容易になるためです。
参考文献
- バロウズ、アンドリュー。 (20131)。 化学:無機化学、有機化学、物理化学の紹介 (第 2 版)。オックスフォード。 ISBN 978-0-19-969185-2.
- チャイ、ヤン;郭、ティン。ジン、チャンミン;ら。 (1991)。 「金属入りフラーレン」。 Journal of Physical Chemistry . 95 (20):7564–7568。 doi:10.1021/j100173a002
- Hill, Edwin A. (1900). 「化学文献の索引付けシステムについて。米国特許庁の分類部門によって採用されました。」 J.午前。化学。社会 . 22 (8):478–494. doi:10.1021/ja02046a005
- ペトルッチ、ラルフ H.;ハーウッド、ウィリアム・S。 Herring, F. Geoffrey (2002)。 一般化学:原理と最新の応用 (第8版)。ニュージャージー州アッパーサドルリバー:プレンティスホール。 ISBN 978-0-13-014329-7.