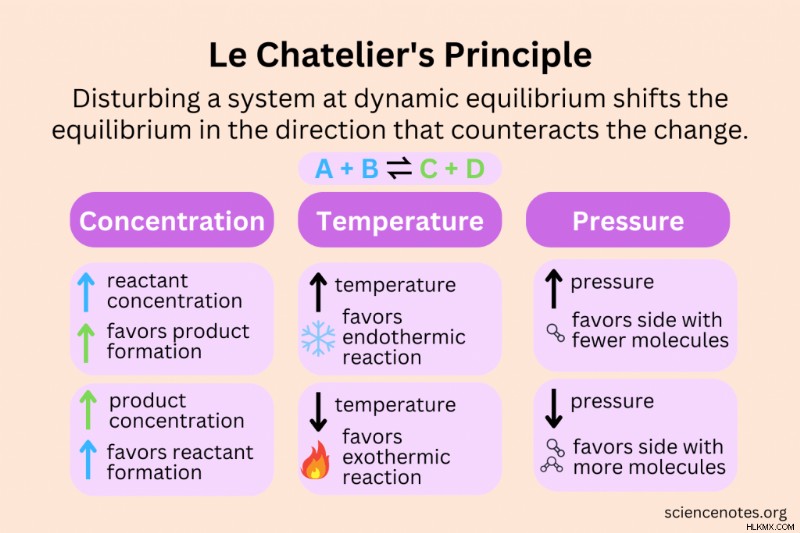
ルシャトリエの原理 動的平衡でのシステムに対する変化の影響を予測します。熱力学的平衡状態 (濃度、温度、圧力、体積など) でシステムの条件を変更すると、システムは変化を打ち消し、新しい平衡を確立するように反応します。ルシャトリエの原理は、もともと化学反応について説明されていましたが、生物学、経済学、薬理学、およびその他の分野における恒常性にも適用されます。ル シャトリエの原理の他の名前は、シャトリエの原理または均衡の法則です。
ル シャトリエの原理の基本
- この原理は、フランスの化学者ヘンリー ルイ ル シャトリエの功績によるものであり、独力で発見したドイツの科学者カール フェルディナンド ブラウンの功績によるものとも考えられています。
- ル シャトリエの原理は、均衡の変化に対する反応の方向を予測するのに役立ちます。
- 原理は、均衡がシフトする理由を説明せず、シフトの方向のみを説明します。
- 集中力 :反応物の濃度を高めると、平衡がシフトしてより多くの生成物が生成されます。生成物の濃度を上げると、平衡がシフトしてより多くの反応物が作られます。
- 気温 :温度変化による平衡シフトの方向は、発熱反応と吸熱反応によって異なります。温度を上げると吸熱反応が促進され、温度を下げると発熱反応が促進されます。
- プレッシャー/ボリューム :ガスの圧力または体積を増加させると、反応が分子の少ない側にシフトします。ガスの圧力または体積を減らすと、反応が分子の多い側にシフトします。
集中力
ル シャトリエの原理は、平衡が変化に対抗する可逆反応の側にシフトすると述べていることを思い出してください。反応の平衡定数は変化しません。
例として、二酸化炭素と水素ガスが反応してメタノールを生成する平衡反応を考えてみましょう:
CO + 2 H2 ⇌CH3 ああ
CO (反応物) の濃度を増加させると、平衡がシフトしてより多くのメタノール (生成物) が生成されるため、一酸化炭素の量が減少します。衝突理論は、プロセスを説明します。 CO が多くなると、反応物分子間の衝突が成功する頻度が増加し、より多くの生成物が生成されます。水素の濃度を上げても同じ効果があります。
一酸化炭素や水素の濃度を下げると逆効果です。減少した反応物質を補うために平衡がシフトし、メタノールの反応物質への分解が促進されます。
メタノールの量を増やすと、反応物の形成が促進されます。メタノールの濃度を下げると、その形成が増加します。そのため、システムから製品を削除すると、その生産が促進されます。
プレッシャー
ル シャトリエの原理は、気体が関与する反応の圧力を増減したときの平衡シフトを予測します。反応の平衡定数は変化しないことに注意してください。圧力を上げると、圧力が下がる方向に反応が変化します。圧力を下げると、圧力が上がる方向に反応が変化します。分子が多い反応側は、分子が少ない反応側よりも大きな圧力をかけます。その理由は、容器の壁に衝突する分子が多いほど、圧力が高くなるためです。
たとえば、一般的な反応を考えてみましょう:
A (g) + 2 B (g) ⇌ C (g) + D (g)
反応矢印 (反応物) の左側に 3 モルのガス (1 A および 2 B) があり、反応矢印の生成物側に 2 モルのガス (1 C および 1 D) があります。したがって、反応の圧力を上げると、平衡は右にシフトします (モル数が少ないほど、圧力が低くなります)。反応の圧力を上げると、平衡は左にシフトします (より多くのモル、より高い圧力)。
ヘリウムやアルゴンなどの不活性ガスを 一定量 加えます 均衡のシフトを引き起こさない。圧力が上昇しても、未反応ガスは反応に関与しません。したがって、ルシャトリエの原理は、反応物または生成ガスの分圧が変化するときに適用されます。不活性ガスを追加してガスの体積を変化させると、このガスを追加するとすべてのガスの分圧が低下します。この場合、平衡はモル数の多い反応側にシフトします。
気温
濃度や圧力の変化とは異なり、反応温度を変化させると平衡定数の大きさが変化します。平衡シフトの方向は、反応のエンタルピー変化に依存します。可逆反応では、一方の方向は発熱反応 (熱を発生し、負の ΔH を持つ) であり、もう一方の方向は吸熱反応 (熱を吸収し、正の ΔH を持つ) です。反応に熱を加える (温度を上げる) と、吸熱反応が促進されます。熱を取り除く (温度を下げる) と、発熱反応が促進されます。
たとえば、一般的な反応を考えてみましょう:
A + 2 B ⇌ C + D; ΔH =-250 kJ/mol
正反応 (C と D の形成) は発熱性で、ΔH 値は負です。つまり、逆反応 (A と B の形成) は吸熱反応です。反応の温度を上げると、平衡は吸熱反応 (C + D フォーム A + B) に有利にシフトします。反応の温度を下げると、平衡は発熱反応に有利にシフトします (A + 2 B が C + D を形成します)。
ルシャトリエの原理と触媒
ルシャトリエの原理は触媒には当てはまりません。触媒を追加しても、正反応と逆反応の速度が等しく増加するため、化学反応の平衡は変化しません。
ルシャトリエの原理例問題
たとえば、気体の SO3 SO2 に分解する そしてO2 :
2 SO3 (g) ⇌ 2 SO2 (g) + O2 (g); ΔH =197.78 kJ/mol
(a) 反応温度を上げるとどうなりますか?
分解反応は吸熱反応であるため、平衡のシフトは正反応に有利に働きます。
(b) 反応に対する圧力を高めるとどうなりますか?
圧力を上げると、圧力が低下するため、ガスのモル数が少ない反応側に有利になり、平衡が左にシフトします (反応物、SO3 ).
(c) さらに O2 を追加するとどうなるか 平衡での反応に?
より多くの酸素を追加すると、反応物 (SO3 ).
(d) SO2 を取り除くとどうなるか 平衡反応から?
SO2 の除去 生成物 (SO2 そしてO2 ).
参考文献
- アトキンス、P.W. (1993)。 物理化学の要素 (第3版)。オックスフォード大学出版局
- カレン、H.B. (1985)。 熱力学と熱統計学の紹介 (第 2 版) ニューヨーク:ワイリー。 ISBN 0-471-86256-8.
- Le Chatelier, H.; Boudouard, O. (1898)、「混合ガスの可燃性の限界」。 Bulletin de la Société Chimique de France (パリ)。 19:483–488。
- Münster, A. (1970)。 古典熱力学 (E.S. ハルバーシュタットによる翻訳)。ワイリー - インターサイエンス。ロンドン。 ISBN 0-471-62430-6.
- サミュエルソン、ポール A (1983)。 経済分析の基礎 .ハーバード大学出版局。 ISBN 0-674-31301-1.