硝酸亜鉛は、染料、医薬品、その他の化学製品の製造において触媒として広く使用されている有機化合物です。セロキサン、二硝酸亜鉛、硝酸亜鉛六水和物など、他にもいくつかの名前があります。硝酸亜鉛の化学式は Zn(NO₃)₂ です。
硝酸亜鉛は、室温で結晶性の白色または無色の固体です。水やアルコールに溶け、六水和物(Zn(NO₃)₂・6H₂O)として存在する。硝酸亜鉛は不燃性であるが、この化合物は他の可燃性物質の燃焼を促進する力を持っている。硝酸亜鉛を加熱すると、有毒である。窒素酸化物が放出されます。
硝酸亜鉛の生産
硝酸亜鉛は、硝酸溶液に亜鉛を溶解することによって製造されます。希釈および濃縮 HNO3 との反応を以下に示します。
Zn + 2 HNO₃ (希釈) → Zn(NO₃)₂ (硝酸亜鉛の式) + H₂
4 Zn + 10 HNO₃ (conc.) → 4 Zn(NO₃)₂ (硝酸亜鉛の式) + NH4NO₃ + 3 H₂O
硝酸亜鉛が熱分解した後、二酸化窒素、酸化亜鉛、酸素が生成されます。
2 Zn(NO₃)₂ (硝酸亜鉛の式) + 熱 → 2 ZnO + 4 NO₂ + O₂
硝酸亜鉛の特性 – Zn(NO₃)₂
| 硝酸亜鉛の式 | Zn(NO₃)₂ (硝酸亜鉛式) |
| 硝酸亜鉛密度 | 2.064 g/cm³ (無水) |
| 硝酸亜鉛の分子量 | 189.36 g/mol |
| 硝酸亜鉛沸点 | 125 °C (約) |
| 硝酸亜鉛の融点 | 110 °C |
硝酸亜鉛の化学的性質
以下は、硝酸亜鉛の化学的性質です:
硝酸亜鉛の熱分解
加熱すると、硝酸亜鉛は分解を受けて、二酸化窒素、酸化亜鉛、および酸素を生成します。以下は、この反応の化学式です:
2 Zn(NO₃)₂ (硝酸亜鉛の化学式) → 2 ZnO + 4 NO₂ + O₂
硝酸亜鉛と炭酸ナトリウムの反応
亜鉛が炭酸ナトリウムと反応すると、炭酸亜鉛と硝酸ナトリウムが形成されます。以下は、反応の化学式です:
Zn(NO₃)₂ (硝酸亜鉛の化学式) + Na₂CO₃ → ZnCO₃ + 2 NaNO₃
硝酸亜鉛が水酸化アンモニウムと反応する場合
硝酸亜鉛と水酸化アンモニウムの溶液との反応により、白色の硝酸アンモニウム沈殿物が得られます。以下は、反応の化学式です:
Zn(NO₃)₂ (硝酸亜鉛の化学式) + 2 NH₄OH → Zn(OH)₂ + 2 NH₄NO₃
硝酸アンモニウムの沈殿物は、水酸化アンモニウムを過剰に加えると溶解します。
硝酸亜鉛と水酸化ナトリウムの反応
硝酸亜鉛が水酸化ナトリウムと反応すると、水酸化亜鉛の沈殿物が得られます。以下はこれに対する反応です:
2 NaOH (水性) + Zn(NO₃)₂ (水性) (硝酸亜鉛式) → Zn(OH)₂ (s) + 2 NaNO₃ (水性) (硝酸亜鉛式)
上記の反応で過剰量の水酸化ナトリウムを加えると、形成された水酸化亜鉛沈殿物が溶解します。
硝酸亜鉛構造 – Zn(NO₃)₂

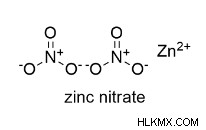
硝酸亜鉛の用途
- 硝酸亜鉛は、配位ポリマーの製造に使用されます。
- 染色工程で媒染剤として使用されます。
- 樹脂の製造における触媒として使用されます。
- 硝酸亜鉛には、強力な酸化剤としていくつかの用途があります。
- 液体肥料やラテックス凝固剤の製造に使用されます。
- 医薬品の製造に使用されます。
硝酸亜鉛の健康被害
硝酸亜鉛の粉塵を吸入すると、鼻やのどに刺激を与え、微量を飲み込むと消化管の腐食を引き起こす可能性があります。皮膚に硝酸亜鉛が接触すると、炎症や皮膚の発疹を引き起こします。
硝酸亜鉛を加熱すると、有毒な窒素酸化物が放出されることがあります。硝酸亜鉛自体は可燃性ではありませんが、他の可燃性物質と接触すると、燃焼の強度が増し、危険な場合があります.
亜鉛とは?
亜鉛は、人体にとって必須の栄養素として機能する元素であり、体内で単独で生成することはできません.したがって、食事で補給する必要があります。酵素反応、遺伝子発現、タンパク質合成、免疫機能、DNA合成、成長と発達、創傷治癒など、体内の多くのプロセスが亜鉛を必要とします.亜鉛は、さまざまな植物性食品や動物性食品に自然に含まれています。自然に亜鉛が不足しているスナックバー、朝食用シリアル、ベーキング用小麦粉などの食品には、体が亜鉛を摂取できるように合成された形態の元素が補充されることがよくあります.亜鉛は免疫システムを強化するため、トローチ、点鼻薬、その他の医薬品に添加されています。
体内での亜鉛の役割
亜鉛は、人体がさまざまな方法で使用する必須栄養素です。体内で鉄に次いで 2 番目に豊富な微量元素であり、すべての細胞にある程度の量が含まれています。
免疫機能における亜鉛の役割とは別に、亜鉛は DNA 合成、皮膚の健康、および体内のタンパク質の生成に重要です。さらに、細胞の成長と分裂に重要であるため、体の成長と発達に果たす役割があります.嗅覚と味覚も、嗅覚の主要な酵素の 1 つとして亜鉛に依存しており、味覚は亜鉛に依存しています。亜鉛が欠乏すると、嗅覚や味覚の知覚が低下します。
亜鉛の健康上の利点
亜鉛には多くの健康上の利点があります。したがって、それは食事で供給されなければなりません。以下にその一部を示します:
- 亜鉛は免疫システムを強化し、それを強く健康に保つのに役立ちます.
- 傷の治癒を早めます。したがって、病院では、特定の潰瘍、火傷、およびその他の皮膚損傷の治療に使用されます.
- 感染症、肺炎、加齢黄斑変性症 (AMD) などの特定の加齢性疾患のリスクを軽減します。
- 亜鉛の局所適用は、にきびなどの皮膚の問題の治療に役立ちます.
- 体内の特定の炎症性タンパク質のレベルを低下させ、酸化ストレスを減少させることにより、炎症を軽減します.酸化ストレスは慢性炎症を引き起こし、がん、心臓病、精神的衰退などのさまざまな慢性疾患の発症の原因にもなります.
重要なポイント
以下は、覚えておくべき重要なポイントです:
- 亜鉛は効果的なルイス酸であるため、ヒドロキシル化やその他の化学物質および酵素プロセスのプロセスにおいて貴重な触媒作用を発揮します。また、多目的な配位構造を示すため、生物学的反応中にタンパク質のコンフォメーションを迅速に変更できます。
- 二酸化炭素とタンパク質消化の調節に重要な亜鉛含有酵素が 2 つあります。それは、カルボキシペプチダーゼと炭酸脱水酵素です。
- 二酸化炭素は、脊椎動物の血液中の炭酸脱水酵素によって重炭酸塩に変換されます。次に、同じ酵素である炭酸脱水酵素が重炭酸塩を二酸化炭素に変換し、肺から吐き出すことができるようにします。この酵素を使用すると、この変換には、標準的な血液の pH 7 で 100 万倍の時間がかかります。血液の pH 10 以上が必要になることさえあります。
- 炭酸脱水酵素は、植物の葉の形成、インドール酢酸の合成、アルコール発酵に必要です。
- 亜鉛は、人間、植物、および微生物に微量必要とされます。それは、1000以上の転写因子と300以上の酵素の働きに不可欠なメタロチオネインに保存され、転送されます。これは、鉄に次いでヒトで 2 番目に多く見られる微量元素であり、酵素のすべてのグループで発生する唯一の金属です。
結論
要約すると、硝酸亜鉛は酢酸の亜鉛塩です。亜鉛と硝酸イオンを含む無機化合物です。したがって、それはイオン性化合物と見なされます。亜鉛金属と硝酸を反応させて製造されます。他の調製方法、硝酸亜鉛の式、化学的および物理的特性、構造、用途、および健康被害を含む、硝酸亜鉛に関するその他の詳細は、記事で説明されています.
よくある質問
1.硝酸亜鉛は幅広い用途がありますか?
A. 硝酸亜鉛には幅広い用途はありませんが、実験室で配位ポリマーの製造に使用されています。制御された方法で酸化亜鉛に分解することができ、この特性を利用して、ナノワイヤなどのさまざまな種類の構造を生成します。また、染色の際の媒染剤としても使用されます。
2.硝酸亜鉛は酸性または塩基性化合物ですか?
A. 硝酸亜鉛は、強酸と弱塩基の塩です。イオン化すると、水中で硝酸イオンと亜鉛イオンが生成されます。塩基性ラジカルである亜鉛イオンの加水分解により、弱塩基の水酸化亜鉛と水素イオンが生成され、溶液が酸性になります。
3.硝酸は亜鉛と反応しますか?
A. はい、硝酸は亜鉛と反応します。濃硝酸との亜鉛とアルミニウムの反応は、受動酸化のプロセスによって高密度で溶解しにくい層が形成されるため、発生しません。この層は、金属をさらなる腐食から保護します。さらに、希硝酸との亜鉛の反応は起こらない。







