クラウジウス・クラペイロンの方程式 は、物質の液相と気相の間の相転移を表す関係です。方程式の形式に応じて、2 つの温度での蒸気圧から液体の蒸気圧または気化熱を予測します。別の用途として、特定の条件下で相転移が発生するかどうかを予測することもあります。
ほとんどの液体の気化曲線は似たような形をしているという前提があります。特定の範囲で、温度の関数としての蒸気圧の変化は、ほぼ線形の関係になります。つまり、温度が上昇すると蒸気圧が上昇します。
この方程式は、ルドルフ・クラウジウスとブノワ・ポール・エミール・クラペイロンにちなんで名付けられました。クラペイロン方程式またはクラウジウス-クラペイロンの関係とも呼ばれます。どちらの名前を選んでも、方程式は物理化学、熱力学、気象学で使用されます。
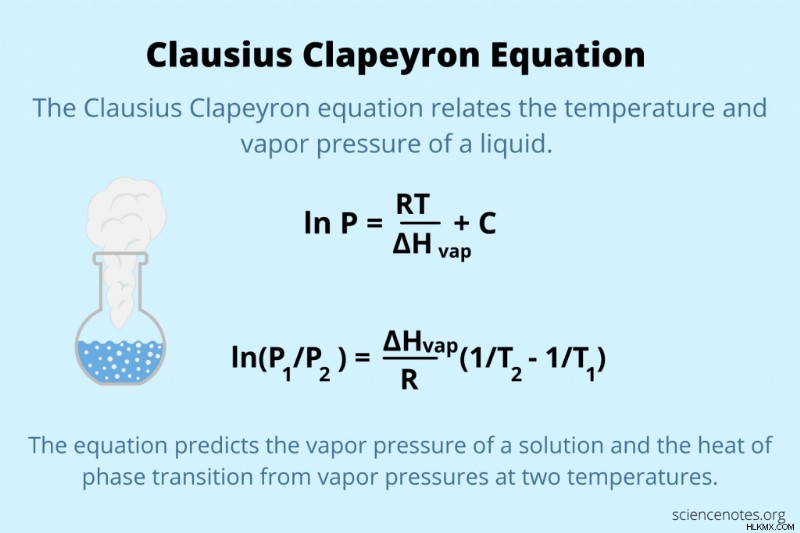
クラウジウス・クラペイロン方程式
クラウジウス・クラペイロン方程式には、微分方程式であるいくつかの形式を含む、いくつかの同等の形式があります。しかし、最も一般的な形式は、単純に気化熱、温度、蒸気圧、または蒸気圧と 1 つの化学物質の対応する温度を関連付けるものです。
ln P =RT/ ΔHvap + C
ln P =– ΔHvap /RT + C
ln(P1 /P2 ) =ΔHvap/R (1/T2 – 1/T1 )
ln(P1 /P2 ) =– ΔHvap/R(1/T1 – 1/T2 )
ln(P2 /P1 ) =– ΔHvap/R(1/T2 – 1/T1 )
ここで、P は蒸気圧、R は理想気体定数 (0.008314 kJ/K・mol)、ΔHvap は物質の気化熱、T は絶対温度 (ケルビン単位)、C は定数です。
液体の蒸発のモル エンタルピーは常に正の数であるため、クラウジウス クラペイロンの式は、温度が上昇すると蒸気圧が常に上昇すると予測します。気化曲線全体にわたって式を使用できますが、気化のエンタルピーは温度によってわずかに変化するため、予測は実験値から逸脱することに注意してください。
クラウジウス・クラペイロン方程式の例題
たとえば、クラウジウス クラペイロンの式を使用して、溶液の蒸気圧を予測できます。蒸気圧が 14.7 °C で 10.0 torr で、気化熱が 47.2 kJ/mol の場合、52.8 °C での 1-プロパノールの蒸気圧を計算します。
最初のステップは、方程式で機能するように単位を変換することです。摂氏温度をケルビンに変換:
TK =°C + 273.15
T1 =14.7 ℃ + 273.15
T1 =287.85K
T2 =52.8 ℃ + 273.15
T2 =325.95 K
次にクラウジウス・クラペイロンの方程式を適用し、P2 を解きます。 :
ln(P1 /P2 ) =ΔHvap/R (1/T2 – 1/T1 )
ln[10トル/P2 ] =(47.2 kJ/mol/0.008314 kJ/K・mol)[1/325.95 K – 1/287.85 K]
ln[10トル/P2 ] =5677(-4.06×10)
ln[10トル/P2 ] =-2.305
方程式の両辺の逆対数を取ります:
10トル/P2 =0.997
P2 /10 トル =10.02
P2 =100.2トル
固体への方程式の適用
クラウジウス クラペイロンの式を使用したほとんどの計算には、液相と気相の間の相転移が含まれます。しかし、この方程式は昇華にも当てはまります。
たとえば、268 K と 273 K での氷の蒸気圧がそれぞれ 2.965 と 4.560 torr である場合、氷の昇華のエンタルピーの熱を推定します。
ΔHsub =R ln(P2 / P1 ) / (1/T1 – 1/T2 )
ΔHsub =R ln(P273 / P268 ) / (1/268 – 1/273)
ΔHsub =(0.008314 kJ/K・mol) ln(4.560 / 2.965) / (1/268 – 1/273)
ΔHsub =52.370 kJ/mol
参考文献
- カレン、H.B. (1985)。 熱力学と熱統計学の紹介 .ワイリー。 ISBN 978-0-471-86256-7.
- クラペイロン、M. C. (1834). 「Mémoire sur la puissance motrice de la chaleur」. Journal de l’École polytechnique (フランス語で)。 23:153–190。
- Clausius, R. (1850)。 「Ueber die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbst ableiten lassen」[熱の動力と熱の理論に関してそこから導き出される法則について]. Annalen der Physik (ドイツ語で)。 155 (4):500–524. doi:10.1002/andp.18501550403
- Iribarne, J.V.;ゴッドソン、W.L. (2013)。 「4.水と空気のシステム § 4.8 クラウジウス-クラペイロンの式」。 大気熱力学 .スプリンガー。 ISBN 978-94-010-2642-0.
- ワーク、ケネス (1988) [1966]。 「一般化された熱力学的関係」。 熱力学 (第5版)。ニューヨーク州ニューヨーク:McGraw-Hill, Inc. ISBN 978-0-07-068286-3.
- Yau, M.K.;ロジャーズ、R.R. (1989)。 雲物理学のショート コース (第3版)。バターワース・ハイネマン。 ISBN 978-0-7506-3215-7.







