コア コンセプト
この記事では、量子力学の重要な概念である分子軌道理論と、分子の結合と反結合を理解するためのその応用について学びます。
他の記事で取り上げるトピック
- 量子数と軌道形状
- パウリ排除原則
- アウフバウ原則
- 電子殻
- 酸素:最も用途の広い元素
分子軌道理論とは
分子軌道理論 (MOT) は、原子間の結合の形成を説明するのに役立つ、原子価結合理論 (VBT) とともに、2 つの基本的な結合理論の 1 つです。特に、分子軌道理論は、結合が原子の挙動を化学的に変化させる方法を説明するのに役立ちます。さらに、この理論は、二原子酸素の常磁性など、原子価結合理論では説明できない現象を説明しています
最も基本的な分子軌道理論では、結合の形成には原子価軌道の混合が含まれ、分子軌道が形成されると述べられています。これは、原子軌道にとどまる共有価電子から結合が形成されると述べている原子価結合理論とは異なります
分子軌道の形成
本質的に、化学結合には、互いの電子に引き付けられる 2 つの原子の原子核が含まれます。 2 つの原子核が互いに接近すると、この引力が増加します。ただし、2 つの原子は、原子核と電子の電荷が似ているため、距離が短くなると互いに反発し合います。最終的に、反発力が相互作用を支配する前に、原子が互いに最も引き付けられる距離が存在します。 2 つの原子がこの完全な引力距離に達すると、それらは化学的に結合していると見なされます。この距離は、次のグラフの最小値 (3) で示されています:
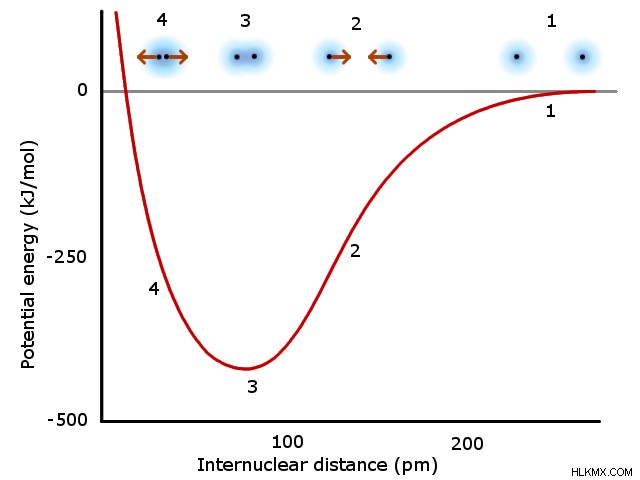
分子軌道理論では、両方の原子の原子価軌道が混ざり合って分子軌道を形成します。価電子がこれらの新しい分子軌道を満たすため、原子軌道を占有する場合とは異なる振る舞いをします。したがって、分子軌道理論に基づく結合は、関与する原子の化学的挙動を本質的に変化させます。

量子力学の法則によれば、各原子の価電子軌道の数は一定でなければなりません。したがって、2 つの 2 つの水素の原子価軌道が混ざり合い、シグマ結合軌道とシグマ反結合軌道の 2 つの分子軌道が形成されます。電子が結合軌道を占有すると、相互引力のシグマ結合が形成されるため、原子のポテンシャル エネルギーが低下します。しかし、反結合性軌道とは正確には何ですか?
結合と反結合
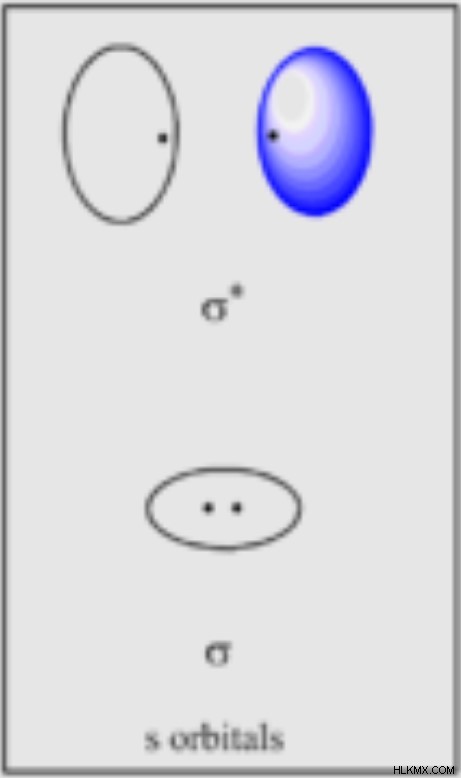
空間的に、2 つの原子核が価電子間に引力を持つためには、それらの電子が 2 つの原子核の間の空間を占有する必要があります。この空間が結合軌道です。
また、原子核は、原子核の反対側の空間を電子が占めている状態で接近することも想像できます。この場合、核の電子への引力により、核が互いに引き離され、結合が妨げられます。この空間は反結合性軌道です。
さらに、電子は音や光のように波として数えられることを思い出すと、共有電子の波の間の建設的な相互作用として結合を考えることができます。 「同相」のときの原子軌道の組み合わせ、つまり電子が両方とも原子核間の空間を占めていることを意味し、相互作用はそれ自体を強化し、結合を形成します。ただし、電子が「位相がずれている」場合、つまり両方が原子核間の空間を占めていない場合、相互作用は破壊的であり、原子核間のさらなる引力が妨げられます。
原子価結合理論と分子軌道理論の違い
次の表は、原子価結合理論と分子軌道理論の違いをまとめたものです。
| 現象 | 原子価結合理論 | 分子軌道理論 |
| 結合軌道 | 結合に関与する電子は、原子価軌道にとどまります。 | 結合に関与する電子は、新しく作成された分子結合軌道に入ります。 |
| 個々の原子化学 | 原子はその特徴的な化学的性質を維持します。 | 電子が分子軌道に移動するため、原子は化学的に変化します。 |
| 価電子の使用 | 一般に、原子の価電子のすべてが結合に関与しているわけではありません。 | 原子のすべての価電子が分子結合軌道に移行し、それぞれが結合に関与します。 |
| レゾナンス | 共鳴分子が化学的に異なることを認めます。 | 分子の共鳴を考慮していません. |
| 分子結合 | 一度に 2 つの原子間の結合関係のみを説明します。 | 分子全体の結合を説明 |
| ハイブリダイゼーション | ハイブリダイゼーションを定義し、特徴付けます。 | ハイブリダイゼーションは示していません。 |
分子軌道理論における結合の例
結合と反結合の両方を理解したところで、いくつかの例を見てみましょう。
H2 絆形成
中性に帯電した水素が 2 つある場合、両方の原子はそれぞれ 1 に 1 つの価電子を持ちます 軌道。水素が近づくと、それらの原子価軌道が混ざり合い、シグマ結合軌道と反結合軌道が形成されます。これらの軌道形成は、分子軌道図を使用して表現できます。
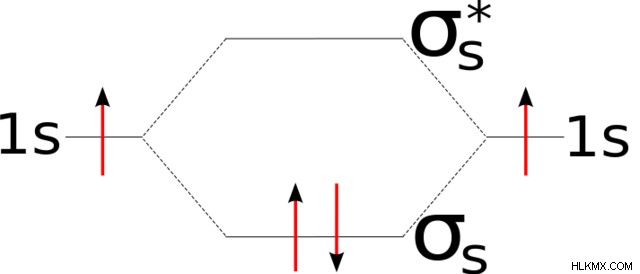
前述のように、結合軌道はポテンシャルエネルギーの低下を伴います。逆に、反結合は、原子が接近するのに抵抗するため、ポテンシャルエネルギーの増加を伴います。分子軌道図は、これらのエネルギー変化を反映しています。具体的には、価電子軌道の下と上にそれぞれシグマ結合軌道と反結合軌道を表示します。
原子はポテンシャル エネルギーを下げようとするため、単一の価電子がシグマ結合軌道を満たし、結合を形成します。

O2 絆形成
2 つの中性荷電酸素により、両方の原子は 4 つの軌道 2s にわたって合計 6 つの価電子を持ちます。 と 2p エネルギーレベル。すべての原子価軌道が分子軌道を形成するため、両方の分子間の 8 つの全原子価軌道が混ざり合って 8 つの分子軌道が形成されます。水素と同様に、2s 軌道はシグマ結合軌道とシグマ反結合軌道を形成します。 3 つの 2 組の 2p 軌道は、同じシグマ軌道、および 2 つのパイ結合軌道と反結合軌道を形成します。

両方とも 2 酸素の軌道は 2 つの電子を保持し、シグマ結合軌道と反結合軌道を満たします。両方とも午後 2 軌道には 4 つの電子があり、両方の酸素の間に合計 8 つの電子があります。最もエネルギーの低い軌道が最初に満たされるため、シグマ軌道とパイ軌道が満たされ、2 つの電子がパイ反結合性軌道を占めるようになります。フントの法則により、電子はそれぞれ別個の反結合性軌道を占有します。
つまり、O2 には 2 つのシグマ結合と 1 つのシグマ反結合があり、これにより 1 つのシグマ結合が得られます。さらに、分子には 2 つの pi 結合と 2 つの半充填 pi 反結合があり、最終的に 1 つの pi 結合が得られます。 1 つのシグマ結合と 1 つのパイ結合があるため、分子結合理論では、原子価結合理論と一致して、酸素に二重結合があると予測されます。

さらに、前述のように、2 つの電子を別々の反結合に配置すると、O2 が形成されます。 常磁性。液体 O2 を注ぐと、この常磁性を観察できます。 強力な磁石の極の間に。その結果、液体酸素は磁場に閉じ込められます。








