コア コンセプト
この記事では、さまざまなタイプの錯体、配位数の重要性、および配位子置換反応を含む配位子の化学を含む、錯イオンとその配位子について学びます。
化学における錯イオンとは?
無機化学では、「複合体」は、1 つまたは複数の配位子への配位共有結合を持つ中心金属イオンを含む構造を表します。化学者は、配位共有結合を形成するために一対の電子を供与できる分子として「リガンド」を定義します。配位子は電子対を供与するため、ルイス塩基として分類されます。逆に、中心金属イオンは電子対を受け入れるため、ルイス酸としてカウントされます。多くの場合、化学錯体はイオン電荷を持っているため、錯イオンを形成します。
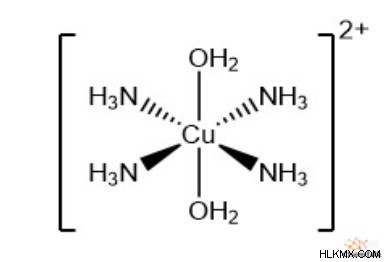
錯イオンの種類
ヘキサアクア コンプレックス
配位錯体イオンの一般的なクラスの 1 つは、水分子の 6 つの配位子を含みます。化学者は、このような複合体を表すために「ヘキサアクアイオン」という用語を使用します。コバルト (II)、銅 (II)、鉄 (II)、鉄 (III)、および他の多くの遷移金属は、ヘキサアクア錯体の中心イオンとして機能します。重要なことは、水分子は中性の電荷を持っているため、複合イオン全体の電荷が中心イオンの電荷と同じままであることです。
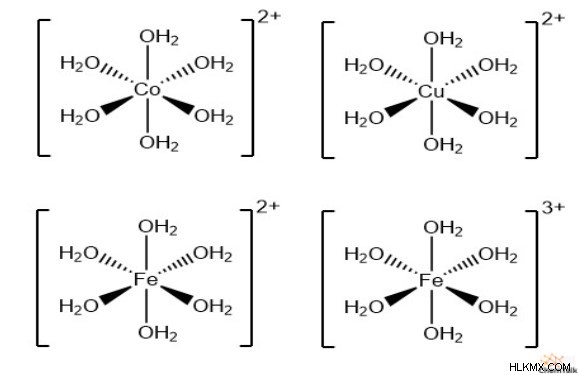
これらの錯体は、金属カチオンが水溶液に溶解すると自然に形成される傾向があります。さらに、配位結合により、複合体は特定の周波数で光を吸収することができ、その結果、特定の金属イオン溶液の色が生じます。

さらに、ヘキサアクアイオンが水と反応すると、錯体はプロトンを放出し、アレニウス酸になります。これが、金属陽イオンを溶液に溶解すると結果的にその pH が低下する理由です。
[Fe(H2 O)6 ] + H2 O ⇌ [Fe(H2 O)5 (OH)] + H3 O
ホモレプティック複合体
化学者は、ホモレプティック複合体を、1 種類の配位子のみを持つ複合体と定義しています。ヘキサアクア イオン コンプレックスは、水のみを含むため、ホモレプティック コンプレックスとしてカウントされます。他のホモレプティック錯体には、[Co(NH3 )6 ]、または [W(CO)6 などの一酸化炭素配位子のみ ]、例えば。
ヘテロレプティック コンプレックス
逆に、化学者はヘテロレプティック複合体を、少なくとも 2 つの異なる種の配位子を持つ複合体と定義しています。ヘテロレプティック錯体の例としては、[Fe(NH3 )4 Cl2 ]、[Co(NH3 )2 (H2 O)4 ]、[Al(H2 O)2 (ああ)2 Cl2 ]、および [Pt(NH3 )2 Cl]。
調整番号 複雑なイオンで
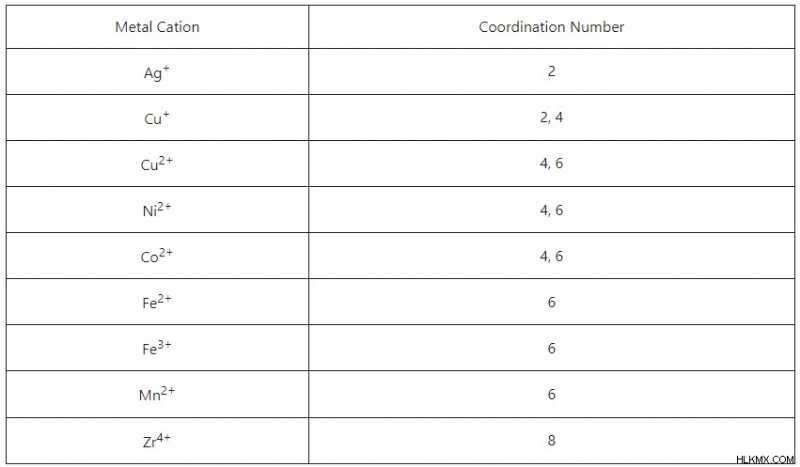
複雑なイオンを予測して特徴付ける場合、イオンの配位数を念頭に置くことが重要です。化学者は、「配位数」(CN)または「配位子」を、中心の金属イオンに結合できる配位子の最大数と定義しています。物理的には、配位数はリガンドが結合できる部位の数を示します。イオンの配位数は 2 ~ 8 で、4 と 6 が最も一般的です。金属イオンの配位数を確実に予測する規則や傾向はありませんが、配位子の立体構造や金属の原子半径などの要因がある程度寄与しているようです。
重要なことに、複合イオンの配位数は、VSEPR 理論と同様の傾向に従って、その分子構造を決定します。
リガンドの種類 複雑なイオンで
多くの異なる分子が配位錯イオンの配位子として機能します。配位子を分類する 1 つの方法は、配位子の電荷に関係します:
- カチオン配位子:NO、N2 H5 、1,1,1-トリメチルヒドラジニウム
- 中性リガンド:H2 お、NH3 、CO、O2 、NH2 ああ
- 陰イオン配位子:F、Cl、Br、I、OH、CN、CH3 OO
配位子を分類するもう 1 つの方法は、金属イオンに結合できる配位子部位の数です。化学者は、この特性をリガンドの「デンティシティ」と呼んでいます。これは、リガンドがイオンから取り出すことができる「噛み付き」の最大数を決定するためです。
最も単純な配位子の多くは「単座」と見なされます。つまり、金属イオンの 1 つの部位にのみ結合します。例:F、Cl、H2 お、NH3 、CO、NO、および他のほとんどの比較的小さな配位子。
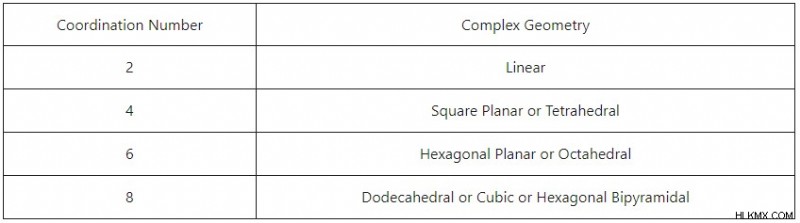
化学者は、複数のリガンド部位に結合できるリガンドに対して「多座」または「キレート」という用語を使用します。多くの場合、これらの配位子はかなり大きな有機構造を持つ傾向があります。金属イオンは、最初の結合と比較して、2 回目以降の結合で多座に対する親和性が高くなる傾向があります。この「多座効果」はエントロピーによって説明されます。その結果、多座の複数の結合が他のリガンドを置換し、その結果、システム内の分子が増加します。
多座配位子の例は次のとおりです:
- 二座:アセチルアセトネート、シュウ酸、エチルジアミン、ビピリジン
- 三座:ジエチルトリアミン、テルピリジン
- 四座配位子:トリエチル テトラミン
- 六座:エチレンジアミン四酢酸 (EDTA)
別の重要なタイプの配位子は、複数の金属イオンに結合できる「架橋配位子」という名前で呼ばれます。架橋配位子は、複数の中心金属との錯イオンの形成を可能にします。例:CO、OH、N3 、および NH2 .
リガンド交換反応 複雑なイオンで
異なる金属イオン配位錯体を合成するために、化学者は配位子交換反応を行い、金属イオンに結合した配位子を置き換えます。ほとんどの錯体イオンはホモレプティック アクア イオンから合成される傾向があります。これは、これらの錯体が水溶性金属カチオン塩を水に溶解することで容易に形成されるためです。
CoCl2 + 6H2 O ⇌ [Co(H2 O)6 ] + 2Cl
この例では、このヘキサアクアコバルト (II) 錯体が、事実上すべてのコバルト (II) 錯体を合成できる基礎を形成します。
重要なことに、金属イオン錯体の形成は可逆的です。したがって、ルシャトリエの原理はすべての配位子交換反応を支配します。ヘキサアクアコバルト (II) 錯体の配位子をアンモニアに置き換えたい場合は、過剰な濃縮アンモニアを追加する必要があります。
[Co(H2 O)6 ] + 6NH3 ⇌ [Co(NH3 )6 ] + 2H2 O
代わりに、配位子交換反応を実行する代わりに、少量のアンモニアのみを追加すると、ヘキサアクア イオンが脱プロトン化されます。これはヘキサアクアイオンの酸性特性によるものです。
[Co(H2 O)6 ] + NH3 ⇌ [Co(H2 O)5 (オハイオ州)] + NH4
重要なことに、これらの脱プロトン水酸化物複合体は、かなりの濃度で沈殿物を形成することがよくあります。
さらに、いくつかの配位子の置換は、金属イオンの配位数を変更します。ヘキサアクアコバルト(II)イオンを濃塩酸に入れると、結果としてテトラコバルト錯体が形成されます。その後、水に比べて大量の塩化物イオンが追加されるため、配位数は 6 から 4 に変化します。
[Co(H2 O)6 ] + 4Cl ⇌ [CoCl4 ] + 6H2 O
最後に、新しい配位子が過剰にある場合でも、一部の配位子交換は不完全なままです。たとえば、ヘキサアクア銅(II)は、アンモニアが過剰の場合にのみテトラアミンジアクア銅(II)を形成します。
[Co(H2 O)6 ] + 4NH3 ⇌ [Co(NH3 )4 (H2 O)2 ] + 4H2 O