コア コンセプト – 化学におけるモル
では、もぐらとは?このチュートリアルでは、化学における重要な測定単位であるモルの定義を学びます。また、アボガドロ数とその有用性についても学びます。ここから、これらの概念を化学の問題解決に使用できるようになります。
他の記事で取り上げるトピック
- 次元分析
- 分子と化合物
- 化学式のバランスをとる
ほくろ数とアボガドロ数の定義
モル、または「モル」は化学の測定単位であり、非常に多数の分子、原子、または粒子を指定するために使用されます。この非常に大きな数は、アボガドロ数と呼ばれます:6.02214 x 10、モルの単位数.これらの数値は、元素の量を知る上で非常に重要です。 1 モルの物質は、最終的に数グラムから数百グラムになります。
もぐらの応用
元素のモル数
元素のモルを見てみましょう。 1 モルには、元素に関係なく、6.02214 x 10 個の原子があります。これは、1 mol の水素には 6.02214 x 10 個の水素原子が含まれ、1 mol の塩素には 6.02214 x 10 個の塩素原子が含まれることを意味します。ほくろには、実験室での作業から化学方程式のバランスを取るまで、化学のあらゆるレベルで多くの用途があります。実際に見てみましょう。
1モルの化合物
化合物、塩化ナトリウム - NaCl のモルを見てみましょう。 1 モルの NaCl には、アボガドロ数の塩化ナトリウム分子が含まれます。1 モルの塩化ナトリウムには、1 モルのナトリウム原子と 1 モルの塩素原子が含まれます。
元素、分子、化合物におけるモル
元素が係数で書かれている場合、その係数はその元素のモル数を示します。たとえば、2C と書くと、炭素が 2 mol あることを意味します。つまり、2モルの炭素原子があります。元素の 1 モルには 6.02214 x 10 個の原子 (アボガドロ数) が含まれていることは既にわかっているため、2 モルは 2 * 6.02214 x 10 個の原子 =12.04428 x 10 個の炭素原子と同じです。この係数の考え方は、化学方程式でよく出てきます。
特定の分子または化合物で、要素に下付き文字がある場合、下付き文字は分子の 1 モルに含まれるその要素のモル数を示します。分子のモル数と分子内の元素のモル数の微妙な違いに注意してください。元素のモル数は、より大きな分子内のその元素のモル数とは異なる場合があります。一見すると混乱するかもしれませんが、いくつかの例を見ると役に立ちます。
化学におけるモルの理解の例
<オール>- 化合物の係数は 1 なので、1 モルの分子 O2 を使用します。
- 1モルのO2 =6.02214 x 10 分子 O2
- 原子 O には下付き文字 2 があるため、これは分子内に 2 モルの O 原子があることを意味します
- 2 モルの O =2 * 6.02214 x 10 個の原子 =12.04428 x 10 個の酸素原子
2. 化合物を分析してみましょう:CH4
- 係数が 1 であるため、1 モルの化合物 CH4 を使用しています。
- 1モルのCH4 =6.02214 x 10 分子 CH4
- 下付き文字が 1
- であるため、化合物内には 1 モルの C があります。
- 1 モルの C =6.02214 x 10 原子 C
- 下付き文字が 4
- であるため、化合物内には 4 モルの H があります。
- 4 モルの H =4 * 6.02214 x 10 原子 =24.08856 x 10 原子 H
3. もう 1 つ難しい問題があります:3NaCl
- 化合物の係数は 3 であるため、3 モルの化合物 NaCl を使用しています
- 3 モルの NaCl =3 * 6.02214 x 10 分子の NaCl
- 化合物内には 3 mol の Na があります (係数は原子にも分配されます!)
- 3 モルの NaCl =3 * 6.02214 x 10 =18.0663 x 10 個の Na 原子
- 化合物内に 3 mol Cl
- 3 モルの NaCl =3 * 6.02214 x 10 =18.0663 x 10 個の Cl 原子
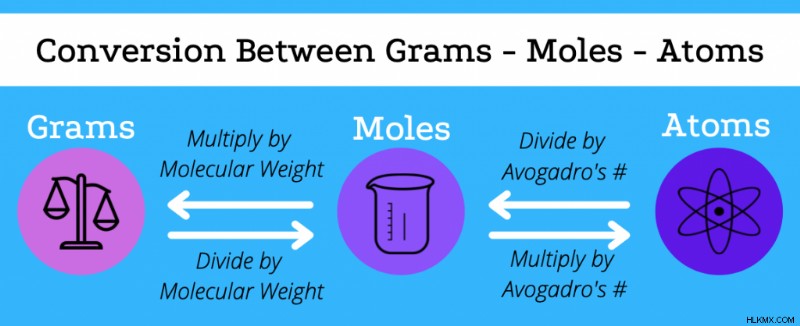
グラムからモルへの変換
元素または化合物の分子量を使用して、グラムをモルに、またはその逆に変換することもできます。化合物の分子量は、その元素成分の分子量の合計であることを思い出してください。
- 化合物のモルが与えられた場合、グラムを求めるには、掛ける 分子量による。
- 化合物のグラムが与えられた場合、モル数を求めるには、除算します。 分子量による。
与えられたグラムで分子の原子を見つけるには、まず分子量を使用してモルに変換し、次にアボガドロ数を使用して原子に変換する必要があります。
グラム換算の例
<オール>- NO2の分子量 は 46 g/mol です
- 1.2 モル単位のグラム数を求めるには、分子量で割ります!
- 9.2/46 =0.2 グラムの NO2
2. 1.5 グラムの CO にはいくつの原子が含まれていますか?
- まず、分子量を使用して CO のグラムをモルに変換します
- CO の分子量は 28 g/mol
- モル CO =1.5 * 28 g/モル =42 モル
- 原子の数を求めるには、モル数にアボガドロ数を掛けます
- 原子 CO =42 モル * 6.02214 x 10 =252.93 x 10 原子 CO
さらに読む
化学のモルとは何か、アボガドロ数について教えてくれてありがとう。より一般的な化学のトピックについては、以下の記事を参照してください!
- 二原子要素
- 化学結合とは
- 化学量論問題の解決
- レドックス反応のバランスを取る方法