熱化学のコアコンセプト
熱化学では、熱の理解と、熱が化学反応にどのように関与しているかを研究します。重要な熱化学方程式は、熱とその世界との相互作用の研究を導きます。熱化学の中心的な概念、いくつかの重要な式、および熱化学の問題を解決する方法について学びます。
熱化学とは?
熱化学は、さまざまな反応に関与する熱を研究する化学の一分野です。熱はエネルギーの一形態です。熱からのエネルギーは、化学反応を促進したり、反応から解放したり、またはその両方を行うことができます!熱化学は、反応でエネルギーが受ける変換を理解し、説明しようとします。
「Thermo」は熱に関することを意味します。そして「化学」は分子と反応の学問です。つまり、熱化学は化学の熱です。
食品化学は、熱化学が一般的な研究である化学の一分野です。私たちの体は糖分や脂肪を分解するときにエネルギーを生み出します。熱化学はこれを説明するのに役立ちます。また、アイス キューブが温かいコップ一杯の水を冷やす方法や、石炭が電力網を動かすためのエネルギーをどのように供給できるかを説明するのにも役立ちます。
熱化学に関連するその他の記事
- 吸熱反応と発熱反応
- 反応、生成、および燃焼のエンタルピー
- 熱力学の法則
熱力学第一法則
熱力学の第一法則は、エネルギー保存則とも呼ばれます。つまり、エネルギーは生成も破壊もできず、形を変えるだけです。より正確に言えば、熱力学の第 1 法則は、システム内の総エネルギー変化は、システムに加えられた熱からシステムによって行われた仕事を差し引いたものに関連していると述べています。この系の熱の研究は、熱化学の研究になります。
反応熱方程式 (別名、反応エンタルピー)
反応エンタルピーとも呼ばれる反応熱は、反応で発生する全体的な熱エネルギーを調べます。これには、反応が発生したときに物質に吸収される熱 (吸熱)、または反応が発生したときに放出される熱 (発熱) が含まれます。 (吸熱反応と発熱反応の説明)
ΔH =ΣΔ H製品 – ΣΔ H反応物
- ΔH :エンタルピー
- ΣΔ H製品 :製品によって吸収/放出された熱の合計
- ΣΔ H反応物 :反応物によって吸収/放出された熱の合計
例:
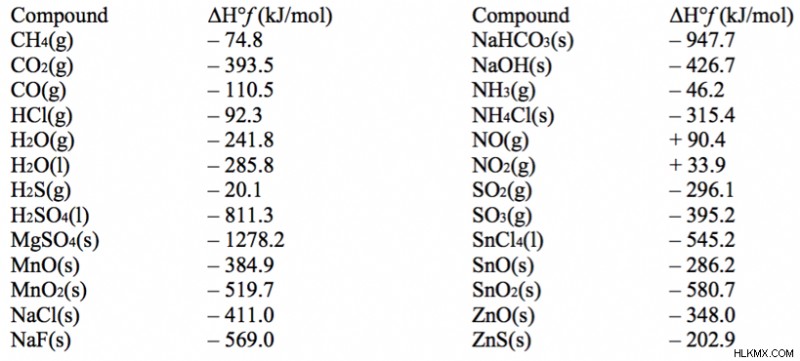
以下を考慮してください:NaOH(s) + HCl(g) -> NaCl(s) + H2 0(g) ΔH=?
ΔH= ΔH製品 – ΔH反応物 =(-411.0 + -241.8) – (-426.7 + -92.3) =-682.8 + 519 =-163.8 kJ/mol
熱量測定
熱量測定は、システムとその周囲との間で発生するエネルギー変化を研究します。システムは、化学反応を受けている物質を表します。手の周囲は、システムと相互作用している他のすべてのものを表しています。較正されたツールである熱量計は、これらのエネルギー変化を測定します。熱量計は、内部で発生する反応をより広い環境から隔離します。家庭での典型的な例として、発泡スチロールのカップの使用が挙げられます。この素材は、カップの内容物間の外側からの熱の相互作用を減らします。
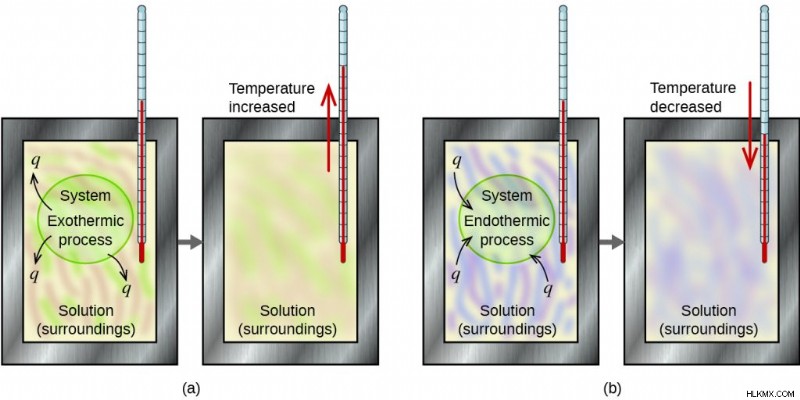
上の画像から理解できるように、理想的な完全な世界で吸収される熱は、放出される熱と常に等しくなります。エネルギー保存の法則により、閉じた熱量計内の全熱交換は 0 に等しくなります。
つまり、qreleased (-q) =q吸収 (q) および -q + q =0.
重要な熱化学方程式
熱容量 (C)
あらゆる物質の熱容量は、温度変化中に吸収または放出できる熱量 (q) を表します。
C =q/ΔT
比熱容量 (c)
比熱容量とは、1 グラムの物質の温度を 1 度上昇させるのに必要な熱量を指します。
c=q/mΔT
物質の比熱容量は、その物質がどれだけ優れたヒートシンクになるかを決定します。例えば、水は比熱が大きいです。太陽が一日中海に照りつけていても、海水の温度は劇的に変化しません。水の比熱容量が小さければ、日中は太陽のエネルギーで海が熱くなり、そのエネルギーが空気中に放散されるため、夜になると劇的に冷えます。水のこの特性は、地球上で生命が機能するための鍵です。
さらに読む
熱化学:熱とエンタルピー







