コア コンセプト
このチュートリアルでは、重量パーセントという計算を紹介します。 .完全に理解するために、例も紹介します。
他の記事で取り上げるトピック
- 利回りの計算
- モル質量の計算
- 混合物と化合物
- モル濃度の計算
- 化学式のバランスをとる
重量パーセントとは?
質量パーセント組成物とも呼ばれる重量パーセントは、w/w%と略すことができる。これは、溶質と溶液の比率を求める計算の一種です。以下の方程式を使用して、問題例を解くことができます:
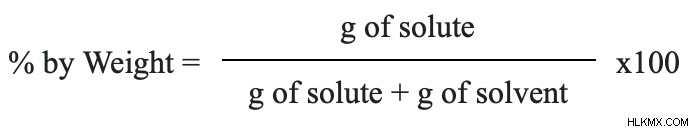
重量パーセントの計算方法
この計算を行うとき、答えにたどり着く方法は、与えられた情報によって異なります。ただし、各方法は同じように終了します。つまり、溶液の総グラム数に対する溶質のグラム数の比率を見つける必要があります。
まず、計算を行うときは、一貫した単位を使用していることを確認する必要があります。グラム単位の量が表示される場合もありますが、同じ単位にするために追加の作業が必要になる場合もあります。たとえば、ある量がミリグラムで表示され、もう一方がキログラムで表示されている場合、正しい変換を使用して変換する必要があります。また、モル質量を使用して変換できるモル単位の量を指定することもできます。これからは、一貫性を保つために単位をグラムで参照します。
次に、溶媒と溶質を含む溶液の総グラム数を見つける必要があります。溶質のグラム数は既にわかっているはずなので、同じ方法を使用して溶媒のグラム数を求めることができます。
最後に、数値を重量パーセントの方程式に当てはめて答えを求めます。
この計算をさらに理解するために、以下の例を見てみましょう!
重量パーセントの例
塩化ナトリウムの重量パーセントを決定する 次の溶液:0.550 キログラムの脱イオン H2 に溶解した 1.75 モルの NaCl (58.44 g/mol) O.
この問題を開始するには、情報を同じ単位 (この場合はグラム) に変換する必要があります。モル質量と単位変換を使用して、溶質 (NaCl) と溶媒 (水) のグラムを見つけることができます。

必要な情報がすべて揃ったので、最後のステップはすべてを数式に組み込むことです。これにより、この溶液が 15.68% NaCl であることがわかります .
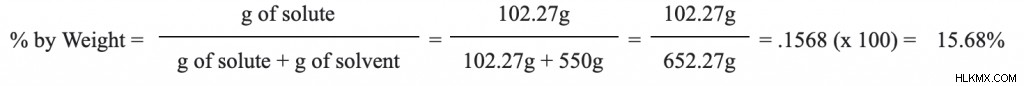
さらに読む
- グループからの脱退
- バリウム
- 固体、液体、気体