コア コンセプト
このチュートリアルでは、モル濃度の公式を学びます 、およびモル濃度の計算方法 モル濃度方程式を使用した溶液の。この記事が気に入ったら、以下にリンクされている他のリソースもチェックしてください!
他の記事で取り上げるトピック
- モル質量の計算
- 混合物と化合物
- 分子と化合物
- モグラとは?
語彙
- モル濃度 (M): 溶液のモル濃度としても知られるモル濃度は、溶液 1 リットルあたりの溶質のモル数です。モル濃度は、mol/L、またはより一般的には M という略語で表すことができます。
- モル質量: 分子を構成する原子量の合計。元素の場合、周期表に表示される原子量と同じ値です。
- 溶質: 溶媒によって溶解される溶液中の物質。それは常にソリューション内のより小さいコンポーネントです。化学では、溶質は溶液中の元素または分子です。
- 溶剤: 溶質を溶かす物質。これが溶液の大部分を構成するもので、通常は水か、場合によっては有機溶媒です。
モル濃度とは?
モル濃度は、溶液 1 リットルあたりの溶質のモル数です。たとえば、食塩を水に溶かした場合、食塩が溶質、水が溶液になります。塩化ナトリウム 1 モルの重さは 58.44 グラムです。 1 リットルの水に 58.44 グラムの NaCl を溶かすと、1M と略される 1 モル溶液になります。溶液の量は後に測定されることを知っておくことが重要です。 溶質は溶解する前ではなく、溶解します。また、モル濃度とモル濃度を混同しないでください 、これは少し異なります!
「1M」と表示されている場合は、「1 モル溶液」と読み上げます。
モル濃度式
モル濃度の式、モル濃度方程式は、M =n /v
M =溶液のモル濃度、別名モル濃度
n =溶質のモル数
v =溶液のリットル
モル濃度はどのように計算しますか?
モル濃度は、上記のモル濃度の式を使用して、体積とモルの 2 つの成分を考慮して計算されます。化合物のモルが不明な場合は、モル質量を使用して化合物をグラムからモルに変換できます。周期表は、モル質量の計算に使用される原子質量を提供します。

ステップ 1:
モル濃度を計算するための最初のステップは、溶液を構成する 2 つの重要な要素の 1 つを特定することです:溶液の体積と、グラムまたはモル単位の溶質の量です。まず、このチュートリアルではボリュームから始めます。溶液の体積は、メスシリンダーを使用して測定できます。モル濃度の場合、体積はリットル単位でなければなりません。開始量がミリリットル単位の場合、モル濃度を計算する前にリットルに変換する必要があります。 1リットルには1000ミリメートルがあります。したがって、簡単な計算で、ミリリットル単位の任意の容量をリットルに変換できます。たとえば、溶液の量が 100 mL の場合:
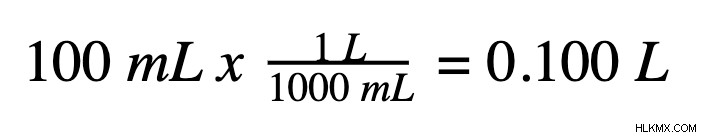
ステップ 2:
2 番目のステップは、モルで溶液中に存在する溶質の量を決定することです。既知の溶質量がグラム単位の場合、モル質量を使用してモルに変換する必要があります。溶質が 5.00 g のアンモニア (NH3 )、これをアンモニアのモル質量 (17.04 g/mol) を使用してモルに変換できます。
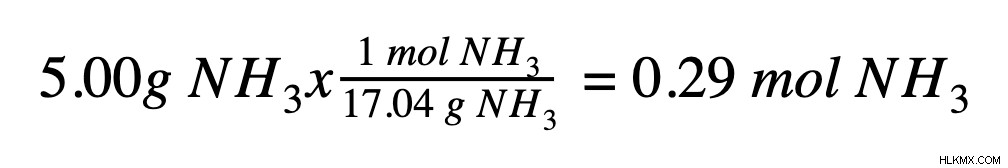
ステップ 3:
3 番目と最後のステップでは、モル濃度の式を使用し、溶質のモル数を溶液のリットル数で割り、モル濃度 (モル/リットル) を求めます。前のステップから 2 つの値を取得すると、アンモニア溶液が 2.9 M であることがわかります。これは、この溶液 1 リットルあたり 2.9 モルのアンモニアが含まれていることを意味します。
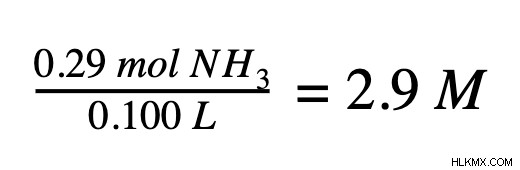
モル濃度を計算する別の例
別の化合物である塩化カルシウムを使用して、同じ方法で溶液のモル濃度を計算できます。これらの値から始めましょう:
- 10.0 g CaCl2
- 200 mL H2 ああ
上記と同じプロセスに従って、いくつかの簡単な手順でこの塩化カルシウム溶液のモル濃度を決定できます。まず、体積をミリリットルからリットルに変換する必要があります。
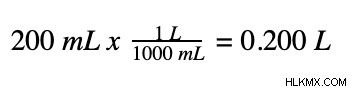
次に、塩化カルシウムのグラムをモルに変換します。
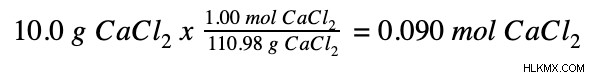
最後に、モル数を溶液の体積で割ります。
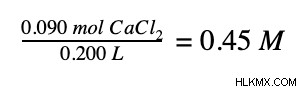
さらに読む
- 実験手順:滴定
- 表面張力と蒸気圧
- 一般的な多原子イオンのリスト