触媒とは?
触媒とは何かについて話しましょう。 触媒 化学反応の速度を高める化合物または元素です。それ自体は反応の一部ではなく、それが発生する速度。一般的に言えば、触媒は反応中に破壊されたり変化したりしません。触媒は活性化エネルギーを下げることでこれを行います 、次のセクションで説明します
活性化エネルギーとは?
簡単に言えば、活性化エネルギーの定義は、2 つ以上の元素または化合物間の反応を開始するために必要なエネルギーです。活性化エネルギーが高い反応は、ゆっくりと進行するか、まったく進行しない可能性があります。反応を加速または開始するには、必要な活性化エネルギーを追加するか、この要件を下げる触媒を使用して、効果的に反応を加速することができます。
活性化エネルギー単位はエネルギー単位です。使用される最も一般的な単位は、KJ/mol または J/mol です。
触媒はどのように機能しますか?
触媒は、活性化エネルギーを減少させることによって反応速度を増加させます。活性化エネルギーの減少は、反応を開始するために必要なエネルギーが少ないことを意味します。
下のグラフは、触媒が存在する場合と存在しない場合の反応のエネルギーを示しています。 x 軸は、反応座標または反応物 (左側) から生成物 (右側) への反応の進行です。 Y 軸はエネルギーです。
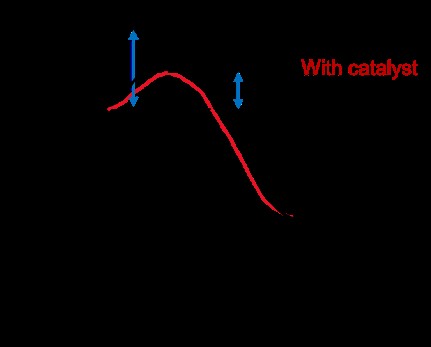
触媒が存在する場合、活性化エネルギー (Ea ) は小さいです。視覚的には、反応が生成物に下り坂になる前に登らなければならない坂が小さくなっています。小さな上り坂を自転車で走る方が大きな上り坂を走るよりも楽なように、活性化エネルギーの丘が小さいほど反応は速く進みます。
触媒は、反応の遷移状態を変化させることによって活性化エネルギーを低下させます。その後、反応は無触媒反応とは異なる経路/メカニズムを通過します。触媒は、反応物と生成物の正味エネルギー差を変えません。遷移状態が変化しても、反応の正味の方程式は、触媒反応と非触媒反応で同じになります。
全体的な反応:A + B + 触媒 –> AB + 触媒
正味の反応:A + B –> AB
触媒の主なカテゴリー
異種触媒
不均一系触媒は、反応物とは異なる相にあります。通常、これは触媒が固相にあり、反応物が液相または気相にあることを意味します。不均一系触媒の別名は表面触媒です。
不均一系触媒は、触媒を固体支持構造に付着させることによって機能し、反応物は触媒の上を流れ、途中で反応します。このタイプの触媒の利点は、反応が完了したときに触媒が生成物から容易に分離されることです。その後、触媒は簡単に再利用できます。製造において、これは重要なコスト削減策です。不均一系触媒の欠点は、反応物と触媒の間の相互作用の量が、表面積と表面からの生成物の拡散によって制限される可能性があることです。
一般的な不均一系触媒は、自動車のガソリン用触媒コンバーターです。別の重要な不均一系触媒は、NH
均一触媒
均一系触媒では、反応物と触媒の両方が同じ相にあります。通常、それらは両方とも液相または気相のいずれかです。
均一系触媒の主な利点は、反応物と触媒の間の相互作用が増加することです。どちらも自由に動くことができるため、相互作用して反応を引き起こす可能性が高くなります.
一般的な均一系触媒は、遷移金属と酸です。均一系触媒反応の 1 つは、大気中の酸素からオゾンへの変換です。一酸化窒素 (NO) は、反応を触媒します。反応の参加者はすべて気相に存在します。したがって、これが均一触媒反応であることがわかります。
酵素
酵素は、生物学的触媒である大きなタンパク質です。それらは体内の強力な力です。多くの場合、それらは 1 つの非常に特定の反応のみを触媒します (はるかに広範な一連の反応を触媒することが多い無機触媒と比較して)。特異性は、触媒の活性部位によるものです。つまり、アミノ酸によって形成される特定の化学組成のポケットであり、非常に特殊な反応モデルが 1 つだけ適合します。これはロック アンド キー モデルとも呼ばれます。
酵素は体内で多くの重要な役割を果たしています。それらは、デンプンの分解を触媒してグルコースを生成します。また、二酸化炭素 (CO2 ) HCO3 など、体が必要とする他の分子へ .酵素は、体内のほぼすべてのプロセスを支援し、スピードアップします。
活性化エネルギーの計算
活性化エネルギーの計算には、アレニウスの式が使用されます。基本はここでカバーされますが、より多くの例と詳細な分析については、アレニウス方程式の記事を確認してください。
アレニウスの方程式は次のとおりです。
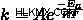
どこ 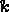 は速度定数、
は速度定数、 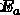 は活性化エネルギー、
は活性化エネルギー、 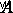 は頻度係数、
は頻度係数、 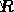 はガス定数で、
はガス定数で、 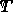 は温度です。
は温度です。
速度定数がわかれば、活性化エネルギーを求めることができます ( 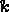 ) さまざまな温度 (
) さまざまな温度 ( 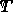 )。活性化エネルギーを決定するには (
)。活性化エネルギーを決定するには ( 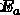 ) プロットします
) プロットします 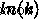 vs
vs  .そうすることで、傾きが – の直線が得られます。
.そうすることで、傾きが – の直線が得られます。 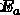 /
/ 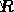 および y 切片
および y 切片 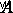 .
. 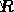 は定数なので、活性化エネルギーを解くことができます。
は定数なので、活性化エネルギーを解くことができます。
活性化エネルギー式の問題例については、アレニウス式のページを参照してください!
一般的な触媒のリスト:
- 五酸化バナジウム(硫酸を作る)
- パラジウム金属
- 二酸化マンガン
- プラチナ金属 (触媒コンバーター中)
- 鉄金属 (ハーバー プロセス)
- 塩化アルミニウム (多くの有機反応)
- 酸化銅 (II)
- 酵素 (生化学反応における天然の触媒)
触媒と活性化エネルギーの語彙の定義
- 活性化エネルギー – 2 つ以上の元素または化合物間の反応を開始するために必要なエネルギー
- 触媒 – 反応速度を高め、反応で消費されない分子
- 売上高 – 1 つの酵素が 1 秒間に触媒できる反応の数
- 酵素 – アミノ酸でできた生物学的触媒
- ロック アンド キー モデル- 酵素と反応物分子が活性部位で類似の形状を持ち、反応の特異性と効率を高めるモデル。
- 均質触媒 – 反応物と同じ相に存在する触媒。
- 異種触媒- 反応物とは異なる相の触媒
触媒とは何か、それらがどのように反応に影響を与え、活性化エネルギーがどのように作用するかを理解していただければ幸いです.これらの概念は、化学反応の動力学をより深く掘り下げれば、より重要になります。 ChemTalk をご覧いただきありがとうございます。







