コア コンセプト
電子親和力に関するこのチュートリアルでは、その定義、関連する周期表の傾向、それに影響を与える要因について説明します。
他の記事で取り上げるトピック
- 電気陰性
- イオン化エネルギー
- 周期表の傾向
- 格子エネルギー
- 電子軌道と軌道形状
電子親和力とは?
化学者は、電子親和力を、電子が気体原子に付加されたときに経験する、kJ/モルの単位で測定されるエネルギーの変化として定義します。この過程でマイナスイオンが発生します。このプロセスは、原子が電子を引き寄せる能力として定義する電気陰性度とは異なります。
私たちは、電子親和力を、原子が電子を獲得する「可能性」または「可能性」に例える傾向があります。これは、気体原子をイオン化し、その結果電子を除去するのに必要なエネルギーであるイオン化エネルギーの反対です。基本的に、電子親和力は 1 つの電子の獲得に伴うエネルギー変化に関係し、イオン化エネルギーは 1 つの電子の喪失に伴うエネルギー変化に関係します。イオン化エネルギーは常に正イオンの形成を伴い、電子親和力エネルギーは負イオンの生成を表します。
一次電子と二次電子の親和性
電子親和力には、第一次電子親和力と第二電子親和力の 2 種類があります。 1 つ目は、中性原子への電子の付加です。 .この発熱過程でエネルギーが放出されるため、第一電子親和力は負の値になります。
2 つ目は、負イオンへの電子の付加に関するものです。 .この吸熱プロセスは、電子がシステムに追加されたときに放出されるよりも多くのエネルギーを必要とします。これにより、正の二次電子親和力値が得られます。
定期的なトレンド
全期間
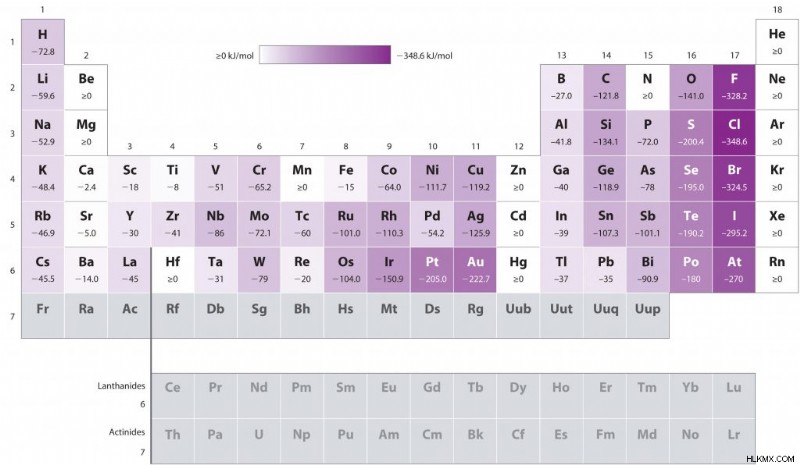
周期表を左から右に移動するにつれて、電子親和力はより正になります。これは、電子付着プロセスがより発熱的であることを意味します。科学者は、このパターンは、これらのより右向きの原子の原子核により近い位置に電子が追加されたことに起因すると考えています。
元素が右に向かうにつれて、追加された電子はそれらの原子核の近くに位置します。これらの電子は、この近接の結果として核に対してより強い引力を示し、それらの電子親和力の発熱性を説明しています。
ダウン グループ
グループを下るにつれて、電子親和力はより負になり、プロセスがより吸熱的になります。これらのそれぞれの核への電子の近接もこの現象に影響を与えますが、以前の傾向に反して、電子はより高いエネルギー準位に配置されます。グループを下っていくにつれて、元素は原子核から離れたところにある電子を含み、これらの電子の結合は弱くなります。
ゆるく束縛された電子は、強く束縛された電子と比較して、原子に結合したときにそれほど多くのエネルギーを放出しません。周期表の下位にある元素は、余分な電子が追加されたときに放出されるエネルギーが少なくなり、電子親和力の発熱性が低下します。
傾向のまとめ
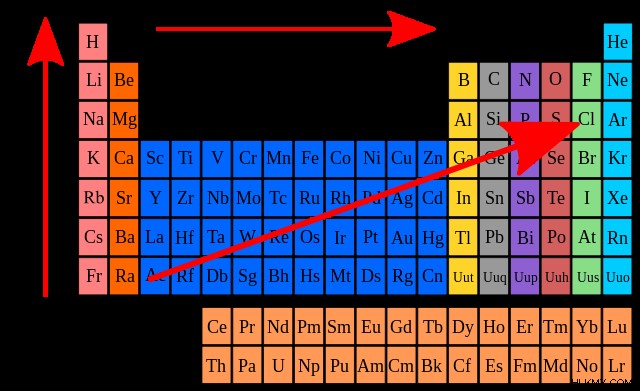
以下は、周期表全体の電子親和力の傾向を視覚的に表したものです。説明したように、電子親和力は期間にわたって左から右に増加します。電子親和力は、上から下のグループに向かって減少します。
シールド効果
価電子が電子親和力の傾向にどのように影響するかを考えてみましょう。電子親和力が減少するにつれて、周期表のグループを下に移動すると、価電子の数が増加します。 シールド効果を考慮することで、これを合理化できます .この規則は、原子核が価電子を引き付ける一方で、反発力がこの引力に対抗することを認めています。これらの反発力は、原子核と外側の電子の間に位置する内側の電子によって生成されます。
各グループを移動するにつれて、シールド効果の影響が増加します。外側の電子とそれぞれの原子核の間の引力が減少し、電子親和力の低い元素が生成されます。
フッ素の例外
フッ素は、グループの電子親和力の傾向に関する別の警告を提示します。負イオンの形成に関与するエネルギーが少ないことに対応して、グループを下るにつれて最初の電子親和力は一般に減少しますが、フッ素原子はこのパターンを破ります.
それぞれのグループの最上位にあることを考えると、フッ素は比較的高い電子親和力を示すと予想されます。フッ素の原子半径が非常に小さいため、原子核を取り囲む空間も非常に小さく、その結果、入ってくる電子とフッ素原子核の間の引力、ひいてはその電子親和力が増加します。
ただし、入ってくる電子は、すでに高レベルの反発の影響を受けている混雑した領域に入ることを覚えておく必要があります。お話ししたように、斥力は電子と原子核の間の引力を減少させ、結果として電子親和力を減少させます。これらの反発効果はフッ素原子で強く、予想よりも小さい電子親和力を示すように促します。
金属 vs 非金属
一般に、金属の電子親和力は低く、非金属の電子親和力は高くなります。
金属
金属は、陽イオンの形成を介して安定したオクテットを形成したいと考えています。これを達成するために、彼らは価電子を放棄する傾向があります。それらは電子を失うとエネルギーを吸収し、親和性の低下と吸熱に寄与します。
非金属
逆に、非金属は完全なオクテットを追求するにつれて、電子を獲得して陰イオンを形成するのが好きです。それらは電子を受け取るとエネルギーを放出し、より高い発熱性の電子親和力を生成します。
原子の電子親和力に影響を与えるものは?
繰り返しになりますが、電子親和力について話すときは、原子が電子を獲得するときに原子が経験するエネルギーの変化を参照します。このプロセスは、この入ってくる電子と関与する原子の原子核との間の引力の量を反映しています。引力が強いほど、より多くのエネルギーが放出され、電子親和力が高くなります。
これらの傾向に影響を与える 2 つの主な要因は、私たちの例に見られるように、原子サイズと核電荷です。より大きな正電荷を持つ原子核は、電子をより強く引き付け、その結果、電子親和力が大きくなります。逆に、正の核電荷が少ないと、電子親和力が小さくなります。
原子サイズに関しては、原子が小さいほど、入ってくる電子を含め、電子が集まるスペースが少なくなります。その結果、この余分な電子は、より大きな原子よりも原子核の近くに配置されます。これにより、この入ってくる電子と原子核の間の引力が増加する結果として、より小さい原子の電子親和力の値が大きくなります。一方、より大きな原子は、電子が入ってくる電子だけでなく、それ自体と共有するためのより多くのスペースを提供するため、より小さな電子親和力を示す傾向があります.
しかし、電子親和力に対する反発と遮蔽の影響を過小評価してはなりません。たとえば、小さい原子はより大きな引力とより大きな電子親和力を示す可能性がありますが、電子を収集するためのスペースが不足しているため、これらの粒子間の反発力も増加します。反発は、入ってくる電子と原子核の間の引力を弱め、電子親和力の低下を促進します。シールド効果も同様に作用します。
これらの要素の影響は、各要素の特性によって異なるため、これらの要素のそれぞれを慎重に検討する必要があります。以下の質問を調査すると、この分析の例が得られます。
電子親和力が最も低い元素は?
水銀は、元素の中で最も電子親和力が低いです。このステータスは、金属としての描写に起因する可能性があります。一般に、金属は、完全で安定したオクテットを追求する際に、電子を得るよりも失う可能性が高くなります。水星の原子半径は比較的大きく、これもその低い値の一因となっています。
電子親和力が最も高い元素は?
塩素は元素の中で最も高い電子親和力を持っています。その高い親和性は、その大きな原子半径、またはサイズに起因する可能性があります。塩素の最も外側の軌道は 3p であるため、塩素の電子には、入ってくる電子と共有するための大量の空間があります。これにより、これらの粒子間の反発が最小限に抑えられ、サイズが大きいことによる引力への悪影響を上回る程度になります。
電子 アフィニティ チャート