コア コンセプト
このチュートリアルでは、化学量論とは何かを学びます また、それに関連するさまざまな種類の問題。コンテンツを練習して習得するために、いくつかの例を紹介します!
他の記事で取り上げるトピック
- 化学式のバランスをとる
- 化学反応とは?
- モル質量の計算
- 利回りの計算
- モル濃度の計算方法
- 有効数字とは
化学量論の定義
化学量論とは?
化学量論 化学反応に関係する数学です。実行できる計算にはさまざまな種類があります。モルを使用した化学量論が最も一般的ですが、質量やパーセンテージで計算することもできます。ここで化学量論の起源について読んでください!化学におけるモルとは何かを学びましょう。
化学量論比
特定の問題における元素または分子の関係について話すとき、化学量論比が作用します。これは、反応が正常に進行するために必要な反応物と生成物の係数の正確な比率です。化学量論について学習するときに目にする可能性のあるいくつかの問題に取り組みましょう。
化学量論の問題
化学式のバランス
化学量論的問題の非常に一般的なタイプは、平衡方程式です。反応が進行するためには、反応物と生成物の正しい比率が必要なため、これは重要な化学スキルです。これは有機化学の重要な基礎でもあります。方程式のバランスに関するチュートリアルがありますが、1 つの例を見てみましょう。
次の反応のバランスを取ります:
__ C2 H2 + __ O2 → __ CO2 + __ H2 O
方程式のバランスをとるときの主な考え方は、反応の両側に同じ数の各要素が存在する必要があるということです。最初に炭素と水素のバランスをとってから、酸素に移動できます。バランスの取れた式は次のようになります:
2C2 H2 + 5O2 → 4CO2 + 2H2 O
例 – 化学量論比 (モル) の使用
以下の方程式を使って問題を解いてください。
C6 H12 O6 → 2C2 H5 オハイオ州 + 2CO2
C6 が 2.5 モルの場合 H12 O6 が反応すると、何モルの二酸化炭素が生成されますか?
次元分析を使用すると、化学量論比を使用してこの問題の解決策を見つけることができます。係数を見ると、C6 の 1 モルごとに H12 O6 、2モルのCO2 生産されます。この比率を使用すると、2.5 モルのグルコースから生成される二酸化炭素のモル数を計算できます。
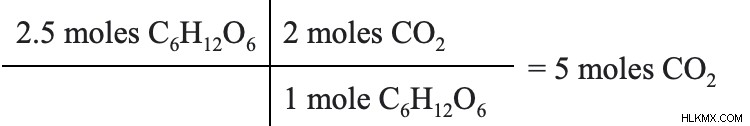
例 – 化学量論比 (質量) の使用
上記の問題と同じ方程式を使用しましょう。
C6 H12 O6 → 2C2 H5 オハイオ州 + 2CO2
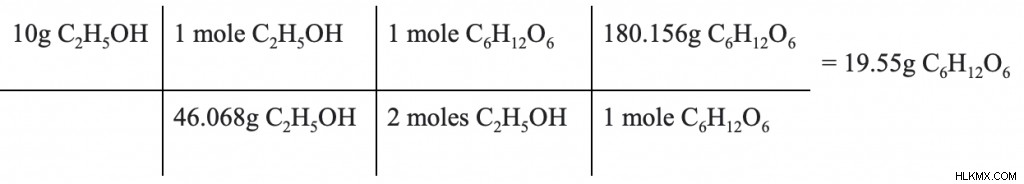
C6 は何グラム H12 O6 C2 が 10g の場合に最初に使用された H5 ああ、生産されましたか?
前の問題と同様に、反応物と生成物の化学量論比を使用して、答えを見つけることができます。次元分析は、C2 のグラムから出発するために使用されます H5 OH 対モル質量対モル (化学量論) 比、およびグラムに戻る。
さらに読む
- 重量パーセント計算
- レドックス反応のバランスをとる
- 正味のイオン方程式の書き方
- 比熱とは?
- 共通イオン効果