化学物質の三酸化硫黄 (ニッソ スルファンとしても知られています) の化学式は SO3 (別名:硫黄) です。三酸化物)。硫黄酸化物によると、「間違いなく商業的に最も重要な」.硫酸の前駆体として大量に生産されます。三酸化硫黄は、気体モノマー、結晶性三量体、固体ポリマーなど、さまざまな形で提供されます。三酸化硫黄は、周囲温度よりわずかに低い温度で固体であり、液体の範囲が狭くなります。酸性雨は主にガス状の SO3 によって引き起こされます。ルイス構造は、分子の価電子殻電子の描写です。分子内の電子がどのように分布しているかを表すために使用されます。最も興味深いトピックは、三酸化硫黄の分子構造です。
三酸化硫黄の分子構造
分子の形成を助ける原子の 3 次元構造は、分子幾何学として知られています。とりわけ、反応性、極性、色、引力、生物活性について知ることができます.
三酸化硫黄では、1 つの硫黄原子と 3 つの酸素原子が可能な限り離れて配置されています。電子は酸素原子を取り囲んでいます。負の電子は負の電子を反発します。
AXN は、SO3 の分子構造を記憶するもう 1 つの方法です。
- 中心原子である硫黄は文字 A で表されます。
- 文字 X は、中央の硫黄に結合している原子の数を表します。
- 非結合電子対は文字 N で表されます。
- この SO3 式には非結合電子がないため、N について心配する必要はありません。さらに、酸素原子が 3 つあるため、結果はX3 になる。
結果として、SO3 分子は AX3 を持っています。 (ちなみに、これが SO3 が Trigonal Planar フォームを持っている理由です。) SO3 の結合角は 120 度です。
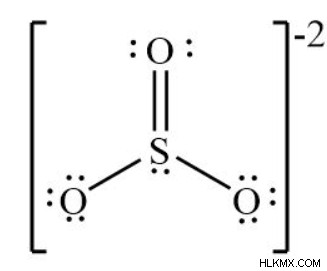
SO3 分子構造 – ルイス構造
- 各原子が方程式に寄与する価電子の数を数えます。 SO3 には合計 24 個の電子があります。 SO3 2- には合計 26 個の電子があります。
- 負電荷が最も少ない原子を真ん中に配置します。硫黄は両方の状況で存在します。
- 硫黄原子の周りに電気陰性度の高い原子を配置すると、それらが 3 つあります。
- 各原子の周りに 6 つの価電子を 2 つずつペアで描画します (これらはすべて 6 つあるため)。
- 1 つの硫黄原子と 3 つの酸素原子の間に合計 12 個の電子があります。
- 二重結合を作る。単結合を形成するには、2 つの電子が必要です。二重結合を形成するには、4 つの電子が必要です。
- 三酸化硫黄には課税されません。硫黄は酸素に比べて弱いため、電気陰性度が非常に高い酸素原子に電子を引き渡します。
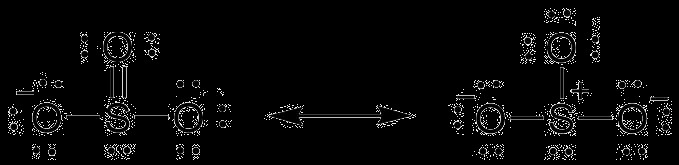
SO3 分子構造 – SO3 が二重結合を生成する原因は?
化学物質である三酸化硫黄は、三角形の平面構造を持っています。硫黄は酸素よりも電気陰性度が低いため、分子の中心を占めています。それは 6 つの電子を所有し、それらすべてを 3 つの酸素原子と共有して、二重結合を形成します。
Sulfur はオクテット規則をどのように破りますか?
SO3 分子構造では、硫黄の価電子数は 6 です。 3s 軌道には 2 が存在し、3p 軌道には 4 が存在します。 8 個の価電子を生成するには、3p 軌道に 2 個の追加の電子が必要です。通常、これは、予想されるフッ化硫黄の化学式が SF4 ではなく SF2 であることを意味します。一方、硫黄の第 3 エネルギー準位の電子は、3d サブ準位にアクセスできます。これは、価電子として 8 個以上の電子をサポートできることを意味します。
結果の軌道はハイブリッドであるため、「dsp3 ハイブリッド」と呼ばれます。硫黄の周りには、1 つの孤立電子対と 4 つの結合対の価電子があります。 d サブレベルは、周期表の最初の 2 つの期間の元素にはアクセスできません。結果として、それらはオクテット規則に従います。
SO3 のハイブリッド化
SO3 には sp2 混成があります。次の式を使用して計算されます:
シグマ結合の数 + 孤立電子対の数 =混成軌道の数
1 つの共有二重共有結合に 1 つのシグマ結合と 1 つのパイ結合が存在します。
したがって、単一の SO3 分子には 3 つのシグマ結合とゼロの孤立電子対があります (ルイス構造)
結果として、混成軌道の数は 3 + 0 =3 です。1 つの軌道と 2 つの p原子内の同じシェルの軌道が重なり合って混合し、sp2 混成で同等のエネルギーを持つ 3 つの新しい混成軌道を形成します。
結論
周期表の周期 3 は、オクテットを拡張して 8 つ以上に対応する傾向がある元素によって特徴付けられます価電子。周期 2 の要素を除くほとんどの要素がこの動作を示すため、この動作は異常ではないことに注意してください。 SO3 では 1 つのシグマ結合と 1 つのパイ結合が形成されるため、ハイブリダイゼーションは sp2 です。これで、SO3 分子構造と SO3 分子構造と結合角の例に関するすべての情報が得られました。したがって、SO3 が 120 度の結合を形成する非極性分子であることは明らかです。







