カルボニル基の紹介
カルボニル官能基は、酸素原子に二重結合した炭素原子です。下の画像では、カルボニル基の構造が (赤で) 強調表示されています。
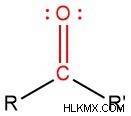
炭素から離れている他の 2 つの結合 (この場合は R と R' というラベル) は、どの原子でもかまいません。カルボニル部分は、酸素に二重結合した炭素だけです (赤で表示)。 -R基が何であるかに応じて、その中にカルボニルを含む別の官能基である可能性があります.これらの官能基は、以下のセクションにリストされています。
カルボニル官能基の詳細
構造内の酸素原子には 2 つの非共有電子対があります。これにより、通常の炭素-炭素二重結合よりも反応性が高くなります。
二重結合の電子は、酸素の電子親和力が高いため、酸素に向かう傾向があります。そのため、構造は次のような共鳴構造を持つように描かれることがあります。
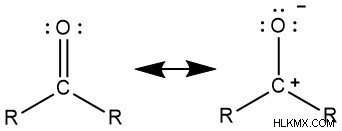
上記の場合、炭素は部分的に正の電荷を持っていますが、酸素は部分的に負の電荷を持っています.
カルボニルの平均二重結合長は約 1.2 オングストロームです。結合は、極性が減少するにつれて長くなります。極性は、炭素が持つ他の結合に基づいて変化します。
IR スペクトルでは、カルボニル基が目立ちます。カルボニル官能基のピークは 1900 ~ 1600cm 付近にあります。スペクトルのこのセクションには、他の多くのピークはありません。カルボニルも非常に強いピークを持つ傾向があります。したがって、IR 分光法は容易にカルボニル ピークを識別し、定量化します。また、他の官能基内のカルボニル ピークを識別するのにも役立ちます。
カルボニル vs ケトン vs アルデヒド vs その他
アルデヒドとケトンは、カルボニルを含む官能基です。主な違いは、これらの官能基の 1 つである酸素に二重結合する以外に、炭素が特定の基に結合する必要があることです。
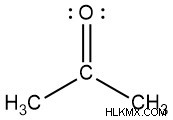
ケトンになるには、カルボニル炭素が 2 つの炭素含有置換基に結合します。これらは同じでも異なっていてもかまいません。以下に、ケトンの例を示します。 R と R’ は炭素を含み、互いに同じか異なる場合があります。最も単純なケトンはアセトンです。アセトンの場合、R と R' の両方がメチル (CH3 ) グループ。
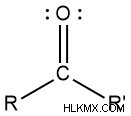
アルデヒドになるには、カルボニル炭素が水素と別の基に結合します。以下に示す分子では、R は何でもかまいません。
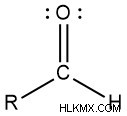
ケトンとアルデヒドは構造が似ているため、互いに同様に反応します。
カルボニル基の反応
カルボニル官能基は、多くの反応を受けることができます。一般に、求核試薬は炭素原子に引き寄せられます。求電子試薬は酸素原子に引き付けられます。
多くの場合、酸はカルボニル酸素原子と反応して、そこに存在する部分的な負電荷を安定化します.
求核試薬がカルボニル官能基の炭素と反応する場合、多くの場合、脱離基はありません。代わりに、二重結合 (パイ結合) の電子が酸素原子に押し上げられます。これは求核付加反応と呼ばれます。
発生する正確な反応は、カルボニル炭素に結合している他の R 基によって異なります。 R基が大きいほど、立体障害により反応が遅くなったり妨げられたりします。たとえば、アルデヒドよりもケトンの方が立体障害が大きくなります。
存在するR基も結合の極性に影響を与えます。極性は分子の反応性にも影響します。
多くの名前付き反応には、カルボニル基が含まれます。以下にその一部を示します。
- アルドール反応:アルドール反応は炭素-炭素結合を生成します
- グリニャール反応:ケトンまたはアルデヒドとの反応から 2 級または 3 級アルコールを形成します
- 野崎・檜山カップリング:アルデヒドをハロゲン化物含有化合物にカップリングします。クロム塩が反応を触媒します。
- ウィッティヒ反応:アルデヒドまたはケトンがイリドと反応してアルケンを形成する
カルボニル化合物
カルボニル基を含むその他の官能基の一部を次に示します
- ケトン (R および R’ =炭素ベースの置換基)

- アルデヒド

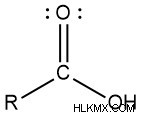
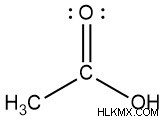
- カルボン酸
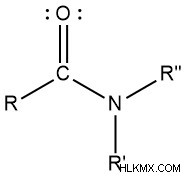
- アミド
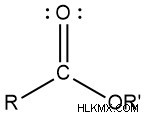
- エステル
以下にリストされているのは、一般的な分子のいくつかのカルボニルの例です.
- ホルムアルデヒド
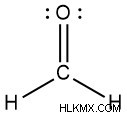
- アセトン
- 二酸化炭素
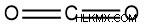
- 酢酸(酢)
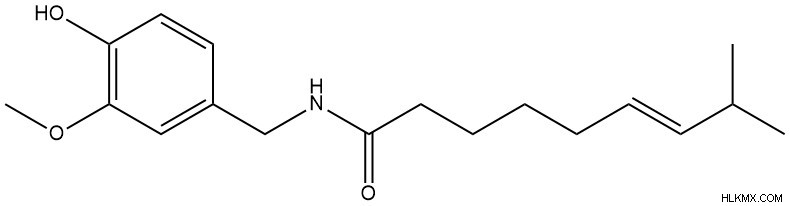
- カプサイシン (トウガラシの辛さの原因となる化合物)