コア コンセプト
このチュートリアルでは、シスとトランスの 2 種類の立体異性体を区別する方法を学習します。さまざまな異性体を分類する方法と、シス トランス異性体の特性の違いを理解する方法を学びます。
他の記事で取り上げるトピック
- 機能グループ
- 求核剤
- 求電子剤
- ニューマン プロジェクション
- 立体異性体とキラル中心
シスおよびトランス異性体とは?
幾何異性は、二重結合の場合のように、結合の周りの回転が制限されている立体異性の一種です。シス異性体とトランス異性体は幾何異性体の一種で、二重結合に関して官能基の位置が異なります。
一般に、シス異性体は二重結合の片側に分子があります。トランス異性体は、二重結合の反対側に分子があります。以下の例で違いを見つけてください:
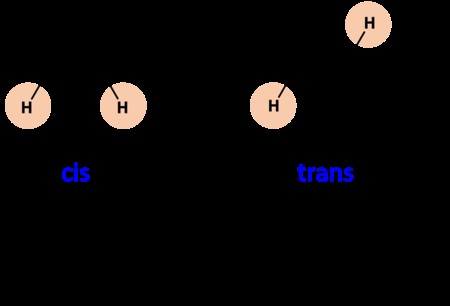
シス 分子は左側にあります。メチル基は両方とも二重結合の同じ側にあります。
トランス 分子は右側にあります:2 つのメチル基は二重結合の反対側にあります
シス異性体とトランス異性体の識別
シス異性体とトランス異性体を識別するには、結合上の官能基を見つけるのが常に最善です。結合には水素原子も含まれることに注意してください。
違いを見つける最も簡単な方法は、二重結合の長さに沿って線を引くか想像することです.シス異性体とトランス異性体の場合、結合の「同じ側」とは、結合の平らな長さを指すことに注意してください。 trans は「~の反対側」を意味し、cis は「~と同じ側」を意味することを思い出してください。
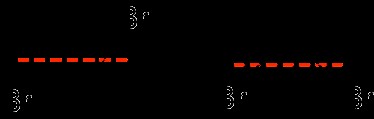
左:トランス分子
右:シス分子
一番左の分子では、ハロゲン (臭素) 基は破線の反対側にありますが、右側の例では、ハロゲン基は二重結合の同じ側にあります.
シス トランス異性体の特性
「U」型の形状のため、シス分子はトランス異性体ほど容易に固体に詰め込まれません。これは、シス異性体の分子間力がそれほど強くないことを意味します。形状は分子の極性にも影響します。シス/トランス分子特性の違いについては、下の表を参照してください。
| 分子 | 極性 | 融点 | 沸点 | 中性溶媒への溶解度 |
| シス | 北極 | 下 | より高い | より高い |
| トランス | 無極性 | より高い | 下 | 下 |
さらに読む
追加の異性体トピックをよりよく理解するには、以下のトピックを参照してください
- エナンチオマーとジアステレオマー







