コア コンセプト
このチュートリアルでは、タンパク質の折りたたみの理由を学びます タンパク質がどのように機能するかにとって重要です。また、タンパク質構造の 4 つのレベルに沿って説明されているように、タンパク質がどのように折り畳まれるかについても学びます。
タンパク質のフォールディングはタンパク質の機能にとって重要です
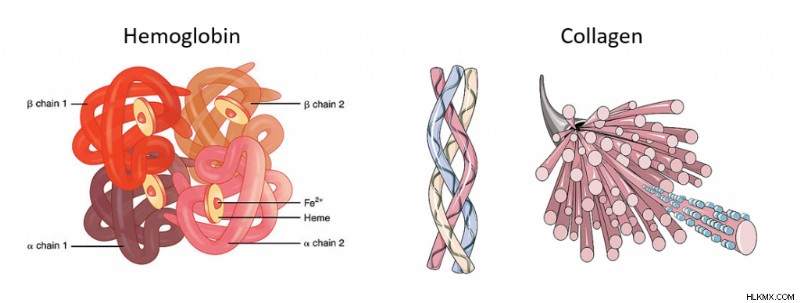
タンパク質の折り畳みは、タンパク質がその形をとるプロセスです。 多くの生物学の授業では、構造=機能とよく言われますが、タンパク質も例外ではありません。たとえば、タンパク質ヘモグロビンは、体中に酸素を運ぶことができる特定の形状をとり、タンパク質コラーゲンは、皮膚が弾力性を維持することを可能にする、異なるが重要な構造を持っています.タンパク質がとる形状は、タンパク質がどのように振る舞うかにとって非常に重要です.
構造によるタンパク質フォールディングの説明
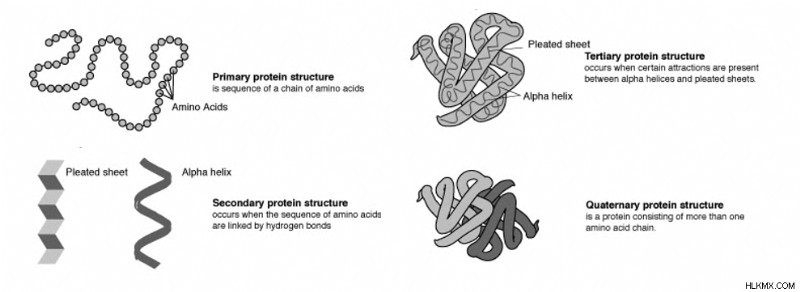
タンパク質構造のレベル
タンパク質構造の 4 つのレベルがタンパク質を表します。最も基本的なものは、アミノ酸の鎖を表す一次構造です。二次構造は、アルファヘリックスとベータプリーツシートの2つの重要な構成の形成を説明しています。三次構造は、タンパク質がどのように折り畳まれるか、つまりタンパク質の二次構造と構造化されていない領域がどのように相互作用するかをより広く説明します。四次構造は、複数のタンパク質鎖が互いにどのように相互作用するかを説明します。
一次配列
タンパク質構造の一次レベルは、最も基本的なものですが、タンパク質がとる形状に不可欠です.タンパク質の一次配列は、タンパク質構造の他のすべてのレベルに影響を与える可能性があります。タンパク質の配列のアミノ酸が変化すると、タンパク質がその形状を失ったり、変化したりする可能性があります.
二次構造
タンパク質の二次構造は、折り畳まれたタンパク質の重要な特徴であるアルファヘリックスとベータプリーツシートを表しています。これらの構造はどちらも水素結合を含んでいますが、水素結合が形成される場所が異なります。
アルファヘリックス
アルファヘリックスは、DNA のコイルによく似た、コイル状に配置されたアミノ酸の鎖です。水素結合はカルボニル酸素から作られ、アミド基は 4 位離れています (図示されていません)。

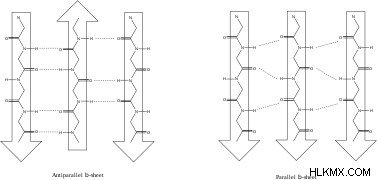
ベータ シート
ベータ シートは、互いに整列したアミノ酸のストランドであり、接続されたアミノ酸の大きなシートを作成します。ベータ プリーツ シートのストランドは、同じ方向性または交互の方向性を持つことができ、それぞれ平行および逆平行のベータ シートを作成します。
三次構造
二次構造の議論では、カルボニル基とアミノ基 (すべてのアミノ酸に存在する) と水素結合を紹介しました。アミノ酸の配列がさらにユニークになると、さらに多くの種類の相互作用が形成されます。タンパク質のカルボニル基とアミン基は、より複雑な方法で互いに相互作用することができ、R 基に存在する各アミノ酸に固有の他の化学的特徴とも相互作用することができます。静電相互作用やジスルフィド結合などの相互作用は、一般にタンパク質構造を一緒に保持します。
静電相互作用
静電相互作用は、電荷に基づいて原子または分子間に形成されます。アミノ酸側鎖または R 基は、リジンのように正電荷を持ち、アスパラギン酸のように負電荷を持ち、グリシンのように中性です。正に荷電したアミノ酸は、負に荷電したアミノ酸を引き寄せます。より一般的には、タンパク質の正の領域が負の領域を引き寄せます。
疎水性相互作用
疎水性相互作用は、疎水性残基 (非極性) がより親水性 (水のように極性) の残基よりも水との相互作用が少ない傾向を表します。電荷を持たず、それ以外の場合は非極性であるアミノ酸は「まとまる」傾向があり、極性残基は水や他の極性物質と相互作用するために、より開いたままになります.
ジスルフィド結合
ジスルフィド結合は硫黄原子間の共有結合であり、通常はアミノ酸のシステインに見られます。ジスルフィド結合またはブリッジとも呼ばれ、タンパク質のアミノ酸間の結合を形成する別の方法に寄与し、タンパク質のフォールディングに寄与します。
四次構造
四次構造は、アミノ酸の 2 つの鎖、または 2 つのタンパク質がどのように相互作用するかを表します。タンパク質の三次構造の安定化に関与するのと同じ相互作用が、タンパク質が四次構造で相互作用するのにも役立ちます。
タンパク質のフォールディングに影響を与えるものは?
折り畳まれたタンパク質内に存在するすべての特定の相互作用により、タンパク質が特定の条件下でのみ安定であるということは理にかなっているかもしれません.タンパク質は、熱、pH、塩分 (存在する塩の量)、および他の分子の存在により、形状を失う、または変性する可能性があります。前に説明したように、一次構造の変化または突然変異も、タンパク質の折り畳み方法に影響を与える可能性があります.
さらに読む
- タンパク質とアミノ酸
- クロマトグラフィーとは
- 水素結合とは?
- イオン結合と共有結合
- 極性と非極性の結合と分子