不活性対効果とは、原子番号の大きい原子の原子価 s- 電子が、内部軌道電子によるこれらの電子の遮蔽が不十分なために化学プロセスに参加することをためらうことを指します。その結果、s電子は結合形成に利用できなくなります。グループに沿って移動すると、この効果はより強くなります。不活性ペア効果により、大きな元素の酸化状態が低下し、小さな元素の安定性が向上します。しかし、不活性ペア効果の間に何が起こり、何が酸化状態として定義できるのでしょうか?この記事では、酸化状態、イナートペア効果、およびイナートペア効果の意味について説明します。
酸化状態とは?
酸化状態は、任意の原子の酸化度として定義できます。化合物。また、異なる元素のすべての原子がイオンである場合に原子が持つであろう仮想電荷として推測することもできます。酸化状態は、正、負、またはゼロの整数で表すことができます。元素の典型的な酸化状態は、いくつかの異常なケースでは分数として描かれます。たとえば、Fe3O4 マグネタイトなど、鉄の値は 8/3 と書かれています。
増加した包括的酸化状態は、ルテニウム、キセノン、オスミウム、イリジウム、ハッシウム、およびいくつかのプルトニウム錯体で +8 です。また、知られている最低の酸化状態は、さまざまな炭素族元素で -4 です。
酸化とは、化学作用による原子の酸化状態の上昇による電子の損失です。控除は、化学式における酸化状態の減少による電子の増加でもあります。
酸化には、従うべきさまざまな規則が記載されています。
結合していない元素であり、酸化状態を持たない遊離元素
簡単な (単原子) イオンの酸化状態は、イオンの正味の電荷に匹敵します。たとえば、Cl – の酸化状態は -1 です。
+1 の水素の酸化状態は、酸化状態が -2 の酸素と相関しています。水素は +1 静的金属水素化物 (LiH など) の酸化値を持ち、過酸化物は -1 の酸化状態 (HO2 など) を持ち、スーパーオキシドは -½ (KO など) の酸化状態を持ちます。
すべての原子の酸化状態の代数的総和は、公平な分子ではゼロでなければなりません。一方、イオンでは、酸化状態の原子の量はイオンの電荷に類似しています。
酸化状態を示す方法は?
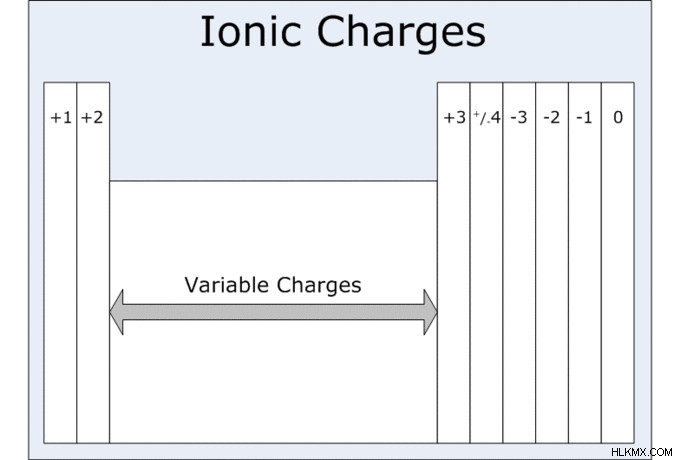
周期表のさまざまな元素の酸化状態は、それらのグループ番号によって定義できます。この表から、III 族の元素であるホウ素の酸化状態は通常 +3 であり、V 族の粒子である窒素の酸化状態は -3 であることがわかります。
しかし、心に留めておくべきことの 1 つは、酸化状態が変化し、基数に依存しないということです。この方法は、共通のガイドラインまたはルールとしても利用できます。たとえば、遷移成分は異なり、グループに依存しないさまざまな種類の酸化状態を持っています。
たとえば、亜硫酸イオン SO32- の累積電荷は 2-であるため、各酸素原子は通常の酸化状態 -2 にあると推測されます。しかし、亜硫酸塩には酸素原子が 3 つあるため、総電荷は 3x 2 =– 6 になります。したがって、亜硫酸塩の酸化状態は +4 であり、電荷は 2-:(+4-6 =-2) であることがわかります。
イナートペア効果とは?
不活性対効果は、元素の特性に対する無視できる効果として定義できます。ただし、この効果は要素により大きな影響を与え、周期的な傾向にも影響を与える可能性があります。主に周期表の遷移元素がこの効果を示します。遷移元素は、最も外側の電子として s 軌道を持ち、化学プロセスの外に留まる傾向があります。
定義 – s 軌道の原子価殻の電子がイオン化できない場合、それは不活性対効果と呼ばれます。あるいは、s 軌道電子を持つ原子価殻の不参加とも言えます。
不活性対効果の限界は何ですか?
不活性対説にはいくつかの制限があります。これを電子の観点から説明すると仮定します。言い換えれば、予想される高いイオン化エンタルピー値です。グループ 13 の要素の例を見て、制限が何であるかを正確に理解しましょう。
このイオン化では、エンタルピーは上下に移動するだけでなく減少します。この表は、いくつかの異常を示しています。Al から Ga へ、およびインジウムからタリウムへのイオン化エンタルピーの増加です。
シジウィックが提案した不活性対効果では、この情報を説明できません。彼らの簡単な説明は、d ブロックの収縮が Ga のイオン化エンタルピーに影響を与えるということです。 Tl の比較的高いイオン化は、d 軌道と f 軌道の遮蔽が不十分なため、相対論的効果によるものです。
不活性対効果の利用
重い p ブロック元素の低酸化状態の高い安定性は、不活性ペア効果によって説明できます。
不活性対効果は、p 軌道要素の s 軌道電子のイオン化値の増加も表します。この手法は、Tl+3 の高度な酸化性と強い反応性も説明しています。
元素の融点と沸点の異常についても説明します。
結論
酸化状態と不活性対効果の問題を解くことで、酸化と不活性対効果について読むことができます。不活性ペア効果は、周期表の 13、14、15、および 16 族の重い元素で発生します。また、グループの原子価を完成させるために 2 つ少ない電子で酸化状態の安定性が向上することも説明しています。







