イオン結合は、金属と非金属の間の結合であり、反対の電荷を帯びたイオンを保持する強力な静電引力として機能します。電子が金属の最外殻から非金属の最外殻に移動すると、電子結合が形成されます。
イオン結合の形成に関与する金属はイオン化ポテンシャルが低く、非金属は電子親和力が高くなければなりません。イオン化ポテンシャルは、孤立した気体原子の最外殻から電子を取り除くのに必要なエネルギー量です。最後に、電子親和力は、孤立した気体原子の最外殻に電子が追加されたときに放出されるエネルギー量として定義されます。
イオン結合または電子結合
2 つの原子間の化学結合は、1 つまたは複数の電子が一方から他方に完全に移動するときに形成され、原子が最も近い不活性ガス構成を達成する原因となります。
3 つの方法のうちの 1 つで、2 つの原子はエネルギーを失い、安定します。電子を供与または受容して、オクテット構成を完成させることができます。このような組み合わせの結果は、電子結合としても知られるイオン結合です。一方の原子が最も外側の準位または軌道から電子を獲得すると、もう一方の原子は電子を失います。
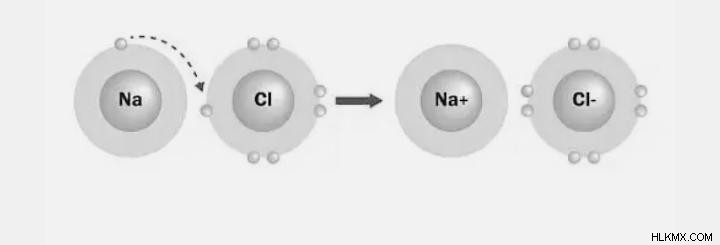
イオン結合
電子がある原子から別の原子に移動すると、正イオンと負イオンが生成されます。電子が 2 つの原子間で輸送されると、イオン結合としても知られる電子結合が形成されます。電子結合を形成できる唯一の材料は、金属と非金属です。非金属間では電気結合は形成されません。
簡単に言えば、ある原子が特定の数の電子を別の原子に移動するときに電子結合が形成され、電子を獲得する傾向があり、その結果、両方の原子に安定した不活性ガス配置が形成されます。静電引力のポテンシャル エネルギーは常に減少します。その結果、システムのポテンシャル エネルギーは、イオン結合が形成される前よりもはるかに低くなります。
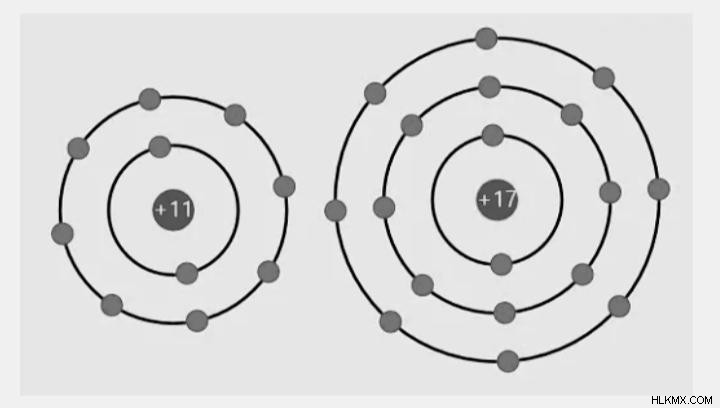
金属と非金属にはイオン結合があります。
イオン結合の特徴
安定性を達成するためにすべての価電子が移動すると、イオン結合が形成されます。
この種の結合により、正の陽イオンと負の陰イオンという 2 つの反対に帯電したイオンが形成されます。
反対に帯電した 2 つのイオンの間には、強い引力があります。
この力は、イオン結合または電子結合として知られています。
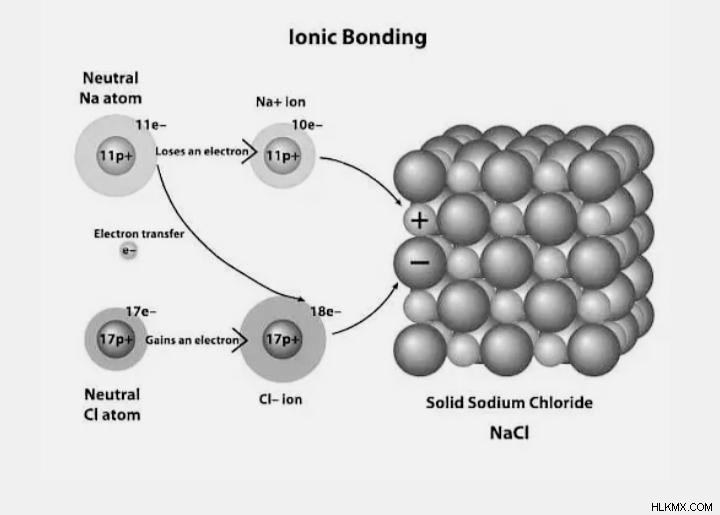
イオン結合構造
電気陰性度の差が大きい場合はイオン結合が形成され、電気陰性度の差が小さい場合は共有結合が形成されます。
イオン性化合物は、互いに静電的に引き付けられる陽イオンと陰イオンで構成されています。
イオン結合の性質
イオン結合の性質は次のとおりです:
<オール>イオン結合は、すべての結合の中で最も強力です。
イオン結合が電荷分離を伴うことが知られているように、イオン結合は正しい媒質内のすべての結合の中で最も反応性が高いです。
イオン結合化合物は融点と沸点が高い.
水溶液または溶融状態では、イオン結合分子は優れた電気伝導体です。これは、電荷キャリアとして機能するイオンの存在によるものです。
結論
イオン結合とは、金属と非金属の間の結合であり、強い静電引力として作用して、反対の電荷を帯びたイオンを一緒に保ちます。電子が金属の最外殻から非金属の最外殻に輸送されると、電子結合が形成されます。
電子がある原子から別の原子に移動すると、正イオンと負イオンが生成されます。電子が 2 つの原子間で輸送されると、イオン結合としても知られる電子結合が形成されます。電子結合を形成できる唯一の材料は、金属と非金属です。
元素原子は、電子を他の原子と頻繁に失ったり、獲得したり、共有したりして、外側準位に 2 つの電子を持つ次の希ガスと同じ電子構造を実現します。デュプレット ルールはこれの名前です。
元素原子は、他の原子との間で電子を頻繁に失ったり、獲得したり、共有したりして、外側の準位に 8 つの電子を持つ最も近い希ガスと同じ電子構造を実現します。オクテット ルールはこれの名前です。
周期表の第 1 族と第 2 族の金属原子が周期表の第 5 族から第 7 族の非金属原子に電子を奪われ、安定した電子配置が完成すると、イオン性化合物が形成されます。デュプレットまたはオクテット ルール。これらの原子の陽子は、これらの電子移動中に変更されません。