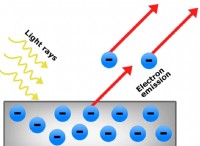
ニールス ボーアは、1913 年に彼のボーアの原子モデルでエネルギー準位の概念を提案しました。彼の水素モデルは、原子核の周りの静止軌道と呼ばれる軌道を回転する電子の安定性を説明しました。エネルギー準位は、原子核から原子核までの距離です。電子が回る軌道。電子は、あるエネルギー準位から別のエネルギー準位に移動するためにいくらかのエネルギーを必要とします。それらは一度に 1 つのエネルギー レベルしか取得できず、2 つのエネルギー レベルの間の空間では見つけることができません。これらのエネルギー準位は、電子殻とも呼ばれます。
エネルギーレベルの概要
エネルギー準位は、主量子数 (n) で表されます。ここで、n=1,2,3….等々。 n =1 のエネルギー準位の電子は、n =2 の電子よりもエネルギーが比較的小さいです。最初のエネルギー準位は「K」、2 番目のエネルギー準位は「L」、3 番目のエネルギー準位は「M」などと表すこともできます。 on.原子核に近いエネルギー準位の電子はエネルギーが小さく、原子核から遠い電子はエネルギーが大きくなります。最も外側の殻に存在する電子は価電子として知られており、外側の殻は価電子殻と呼ばれています。原子のいくつかの基本的な性質は、価電子殻電子に基づいています。エネルギーレベルの重要性
エネルギー準位の研究は、元素のさまざまな化学的性質を理解するために重要です。元素の化学結合を学び、分子軌道がどのように形成されるかを理解するのに役立ちます。電子とそのエネルギー状態
電子はエネルギーを吸収し、低いエネルギー準位から高いエネルギー準位にジャンプすることができます。また、電子はエネルギーを放出することによって、高いエネルギー準位から低いエネルギー準位にジャンプすることもできます。エネルギーの放出は、通常、光の形で行われます。したがって、これらのプロセスは両方とも、光の放出または吸収を必要とします。より低いエネルギー準位は基底状態として知られていますが、より高いエネルギー準位は電子の励起状態として知られています。量子数
電子は、これらの 4 つの量子数の助けを借りて、原子内で識別できます。主量子数 (n):電子が存在する主殻と電子のエネルギー準位について教えてくれます。方位量子数 (l) :メイン シェルに存在するサブシェル (s、p、d、f) の数がわかります。また、電子の角運動量とサブシェルの形状も表します。s の場合は l=0、p の場合は l=1、d の場合は l=2 です。磁気量子数 (m):軌道と方向について教えてくれます。各サブシェルの。 m =-l から +l の値。各サブシェルに存在する軌道の数は (2l+1) として与えられます。スピン量子数 (s):電子のスピンの方向を示します – 時計回りまたは反時計回り。エネルギーレベル図
エネルギー準位図は、同じエネルギー準位のすべての軌道が同じエネルギーを持っていないことを示しています。- 軌道 2s と 2p は一緒に配置されていないため、同じエネルギーを持っていません
- エネルギーの低い軌道は、s
- エネルギーレベル 3 の場合、3s <3p <3d
- エネルギーレベル4の場合、4s <4p <4d
- 低いエネルギー レベルの最も外側のサブシェルは、高いエネルギー レベルの最も内側のサブシェルよりも安定しています