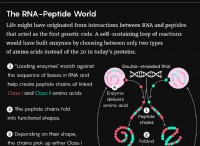
配位または錯体化合物とは、金属原子またはイオンが2つ以上の陰イオンまたは中性分子に配位している化合物を指す。ほとんどの場合、配位化合物には 1 つまたは複数の複雑なイオンが含まれています。例えば、K4[Fe(CN)6]4+は錯イオン[Fe(CN)6]4+で構成されている。配位子は、錯体化合物の形成中に中心金属原子に直接結合する化学種またはイオン種です。配位結合は、配位子を中心原子または中心イオンに接続します。その結果、配位子は配位基、分子、または錯体イオンのイオンと呼ばれることがあります。
二座配位子は、原子と 2 つの配位共有結合を形成できる物質または陰イオンです。二座配位子には 2 つのドナー原子があります。これは、孤立電子対を供与できる原子が 2 つ存在することを意味します。
リガンドとは?
<オール>リガンドの種類
1つまたは複数のドナー部位をリガンドで検出することができる。リガンドは、ドナー サイトの数に応じて、次のカテゴリのいずれかになります。
<オール>配位子は、分子ごとに配位共有結合を 1 つしか確立できない場合、単座であると言われます。ドナー部位が 2 つある場合、配位子は二座配位子です。この分類は、配位子の密度によって記述されます。キレートの配位子は 2 つ以上のドナー部位を介して中央の金属原子に結合しているため、配位子は二座または多座のいずれかになります。キレートの配位子は、通常、構造が環状または環状です。キレート剤は、これらの配位子の別名です。
二座配位子
二座配位子は、原子と 2 つの配位共有結合を形成できる物質または陰イオンです。正に帯電した金属原子などの電子が豊富な化学種が、電子不足の化学種に孤立電子対を提供すると、配位共有結合が形成されます。このように配位子と陽イオンが結合すると、配位化合物が生成されます。配位中心は、配位子が結合している原子です。二座配位子には 2 つのドナー原子があります。これは、孤立電子対を供与できる原子が 2 つ存在することを意味します。
二座配位子の例
二座配位子には 2 つのドナー原子があることがわかっています。これは、孤立電子対を供与できる原子が 2 つ存在することを意味します。
二座配位子には以下が含まれます:
1,2-イアミノエタン (H₂NCH₂CH₂NH₂)、別名エチレンジアミン (en)
シュウ酸イオン (ox) とも呼ばれるエタン二酸イオン (C₂O₄²⁻)。
二座リガンドと両座リガンドの類似点
以下は、二座配位子と両座配位子の類似点です:-
<オール>二座リガンドと両座リガンドの違い
以下は、二座リガンドと両座リガンドの主な違いの一部です:-
<オール>二座配位子は、原子に結合できる 2 つの配位共有結合を持つ分子です。両座配位子には 2 つのドナー原子がありますが、一度に 1 つの原子にしか結合できません。
両座配位子の例:チオシアン酸イオンと硝酸イオン.
結論
配位子が配位分子の基本的な構成要素であると結論付けるのは合理的です。配位中の化学配位子は、中心の金属原子と結合し、結果として配位錯体を生成する分子またはイオンです。それは電子対ドナーとして機能しますが、中心原子は電子対アクセプターとして機能します。二座配位子は、原子と 2 つの配位共有結合を形成できる物質または陰イオンです。二座配位子と両座配位子の主な違いは、二座配位子は中心原子と 2 つの結合を同時に作成できるのに対し、両座配位子は中心原子と 2 つの結合を確立できますが、一度に 1 つの結合しか形成できないことです。 2 組の電子を金属原子に与えることができるルイス塩基は、二座配位子として知られています。二座配位子は、2 つの異なる位置で金属原子に結合している可能性があるため、キレート配位子とも呼ばれます。