多くの物理学者が原子の構造を説明しようとしました。 J.J.トムソンは、最初に原子の構造モデルを提案しました。このモデルは、プラムプリンに似た原子の構造を考慮したものです。しかし、彼のモデルは、原子の特定の重要な要素を説明できませんでした。アーネスト・ラザフォードは、有名な英国の物理学者でした。彼は、トムソン モデルと矛盾するモデルを提案しました。ラザフォードは、原子の構造を理解するために古典的なアルファ線散乱実験を行いました。アルファ線散乱実験ノートに関する次のセクションは、このトピックを完全に理解するのに役立ちます。
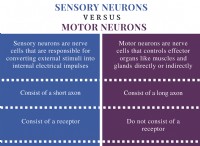
プラム プディングと原子の惑星モデルの違い
ラザフォードの原子モデル
ラザフォードは、原子の構造について次のような結論を出しました。これは、彼が古典的な実験を行った後のことです。
アーネスト・ラザフォードの原子モデルによると:
<オール>小さくて濃縮された、正電荷を帯びた核があります
すべての質量が集中
電子は軽量で負に帯電しています
電子はその周りを非常に高速で回転します
電子の軌道は軌道と呼ばれます
惑星モデルとも呼ばれます
Atom にはほとんどスペースがあります
電子の経路を予測できます
電子と原子核は強い力でくっつく
原子全体は電気的に中性です
原子の核モデルとも呼ばれます
アーネスト ラザフォードのアルファ線散乱実験
厚さ 100 nm の薄い金シートを使用しました。非常に薄い層が必要だったため、選択されました。 𝛂粒子の高エネルギー光線が衝突しました。 𝛂 粒子は、2 価のヘリウム イオンです。これらの粒子の質量は約4μです。彼らはかなりの量のエネルギーを持っています。それは放射線源によって提供されました。箔の周りに硫化亜鉛スクリーンを使用した。 𝛂粒子のたわみを観察するために行われました。ラザフォードは、原子内の電子の配置を知りたがっていました。彼は、金箔との相互作用後の𝛂粒子の経路を研究しました。
実験からの観察
ラザフォードのアルファ線散乱実験からの重要な観察結果は次のとおりです:
<オール>ほとんどの 𝛂 粒子は、たわむことなく金シートを通過しました。
推論:
空のアトムには多くのスペースがあります。
非常に小さな角度で金シートによってそらされる 𝛂 粒子はほとんどありません。
推論:
原子の正電荷が凝縮されています。
原子内に均一に分布していません.
大きな角度でずれたり、跳ね返ったりする粒子はほとんどありません。
推論:
正電荷は、原子内で非常に小さな体積を占めます。
実験の限界
ラザフォードのモデルは、電子が原子核の周りを固定軌道で回転することを説明しました。マクスウェルによれば、加速された荷電粒子は電磁放射を放出します。したがって、ラザフォードの原子モデルの電子は電磁放射を放射します。電子は放射線にエネルギーを提供します。これには軌道収縮がかかります。したがって、電子はコアで崩壊します。約 10-8 秒かかります。
推論:
原子の安定性を説明できませんでした.
原子内の電子の配置について、特に何も観察されていません。
推論:
ラザフォードの理論は不完全でした。
アルファ線散乱実験の重要な公式
<オール>散乱するアルファ粒子の数は
N ∝ 1 sin4(𝜃/2)
N/t =定数、ここで
N =ある方向に散乱するアルファ粒子の数
t =ホイルの厚さ
アルファ粒子が到達できる原子核までの最も近い距離は r0 で与えられました。これを最接近距離と呼ぶ。また、初期の運動エネルギーは位置エネルギーに変換されます。最接近距離と運動エネルギーの関係は、
r0 =4kZe2/mv2
結論
ラザフォードのアルファ散乱実験で、彼は正に帯電した粒子で構成された非常に小さな密度の高い領域を発見したため、この部分を核と名付けました。金シート上にアルファ粒子を散乱させた後、ほとんどの粒子が金箔をまっすぐ通過し、たわみがないことが観察されました。このことから、原子内のほとんどの空間は空であると結論付けることができます。マクスウェル電子は電磁放射を放出します。しかし、ラザフォードの原子モデルを調べると、電子が電磁放射を放出すると、電子は崩壊し、徐々に収縮します。したがって、電子は加速された荷電電子のために常にエネルギーを失います。これは、ラザフォードの原子モデルの大きな欠点です。