主な違い - 電子幾何学と分子幾何学
分子の形状によって、その分子の反応性、極性、生物活性が決まります。分子の幾何学は、電子幾何学または分子幾何学のいずれかとして与えることができます。 VSEPR 理論 (原子価殻電子対反発理論) は、分子の形状を決定するために使用できます。電子配置には、分子内に存在する孤立電子対が含まれます。分子構造は、特定の分子が持つ結合の数によって決定できます。電子幾何学と分子幾何学の主な違いは、電子幾何学は分子内の孤立電子対と結合の両方を取ることによって発見されるのに対し、分子幾何学は分子内に存在する結合のみを使用して発見されることです。 .
対象となる主な分野
1.電子幾何学とは
– 定義、識別、例
2.分子幾何学とは
– 定義、識別、例
3.分子の幾何学とは
– 説明図
4.電子幾何学と分子幾何学の違いは何ですか
– 主な相違点の比較
重要な用語:電子幾何学、孤立電子対、分子幾何学、VSEPR 理論 
電子幾何学とは
電子幾何学は、結合電子対と孤立電子対の両方を考慮して予測される分子の形状です。 VSEPR 理論は、特定の原子の周りにある電子対が互いに反発すると述べています。これらの電子対は、結合電子または非結合電子のいずれかになります。
電子の幾何学は、分子のすべての結合と孤立電子対の空間配置を示します。電子の幾何学は、VSEPR 理論を使用して取得できます。
電子の配置を決定する方法
以下は、この決定に使用される手順です。
<オール>例
CH4 の電子配置
分子の中心原子 =C
C の価電子数 =4
水素原子から寄付された電子の数=4 x(h)
=4 x 1 =4
C の周りの電子の総数 =4 + 4 =8
電子グループの数
存在する単結合の数 =4
孤立電子対の数 =4 – 4 =0
したがって、電子の幾何学

図 1:CH4 の電子配置
アンモニア (NH3) の電子配置
分子の中心原子 =N
N の価電子の数 =5
水素原子によって供与された電子の数 =3 x (H)
> =3 x 1 =3
N の周りの電子の総数 =5 + 3 =8
電子グループの数 =8 / 2 =4
存在する単結合の数 =3
孤立電子対の数 =4 – 3 =1
したがって、電子の幾何学

図 2:アンモニアの電子配置
AlCl3 の電子配置
分子の中心原子 =Al
Al の価電子数 =3
Cl 原子によって供与された電子の数 =3 x (Cl)
N の周りの電子の総数 =3 + 3 =6
電子グループの数 =6 / 2 =3
存在する単結合の数 =3
孤立電子対の数 =3 – 3 =0
したがって、電子のジオメトリ =三角平面
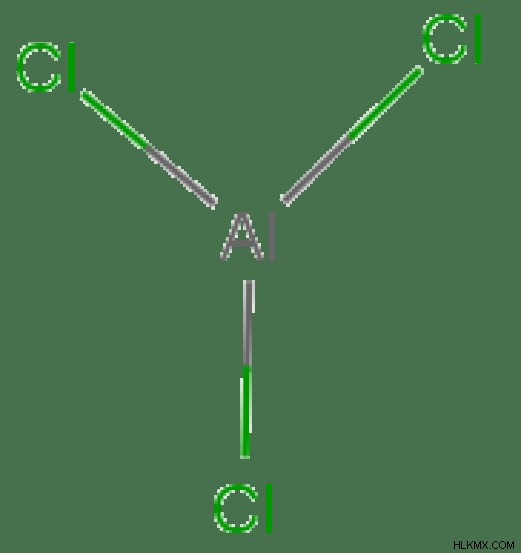
図 3:AlCl3 の電子配置
時々、電子の幾何学と分子の幾何学は同じです。これは、孤立電子対が存在しない場合、ジオメトリの決定では結合電子のみが考慮されるためです。
分子幾何学とは
分子幾何学は、結合電子対のみを考慮して予測される分子の形状です。この場合、孤立電子対は考慮されません。さらに、二重結合と三重結合は単結合と見なされます。ジオメトリは、孤立電子対が結合電子対よりも多くのスペースを必要とするという事実に基づいて決定されます。たとえば、特定の分子が 2 対の結合電子と孤立電子対で構成されている場合、分子の形状は線形ではありません。孤立電子対は 2 つの結合電子対よりも多くのスペースを必要とするため、そこのジオメトリは「曲がったり角張ったり」しています。
分子構造の例
H2 の分子構造 ああ
分子の中心原子 =O
O の価電子数 =6
水素原子によって供与された電子の数 =2 x (H)
=2 x 1 =2
N の周りの電子の総数 =6 + 2 =8
電子グループの数 =8 / 2 =4
孤立電子対の数 =2
存在する単結合の数 =4 – 2 =2
したがって、電子幾何学 =曲がった 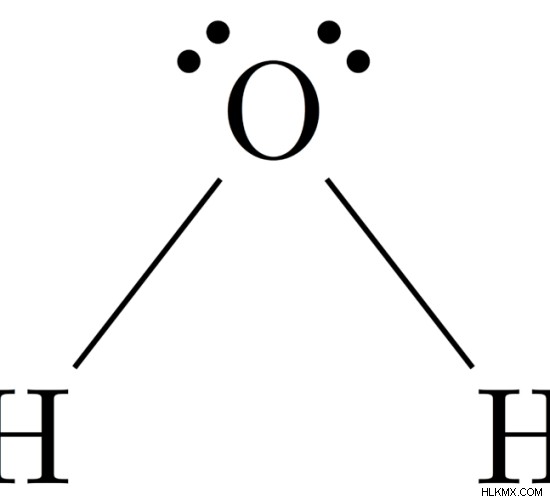
図 4:H2O の分子構造
アンモニア (NH3) の分子構造 )
分子の中心原子 =N
N の価電子の数 =5
水素原子によって供与された電子の数 =3 x (H)
=3 x 1 =3
N の周りの電子の総数 =5 + 3 =8
電子グループの数 =8 / 2 =4
孤立電子対の数 =1
存在する単結合の数 =4 – 1 =3
したがって、電子の幾何学
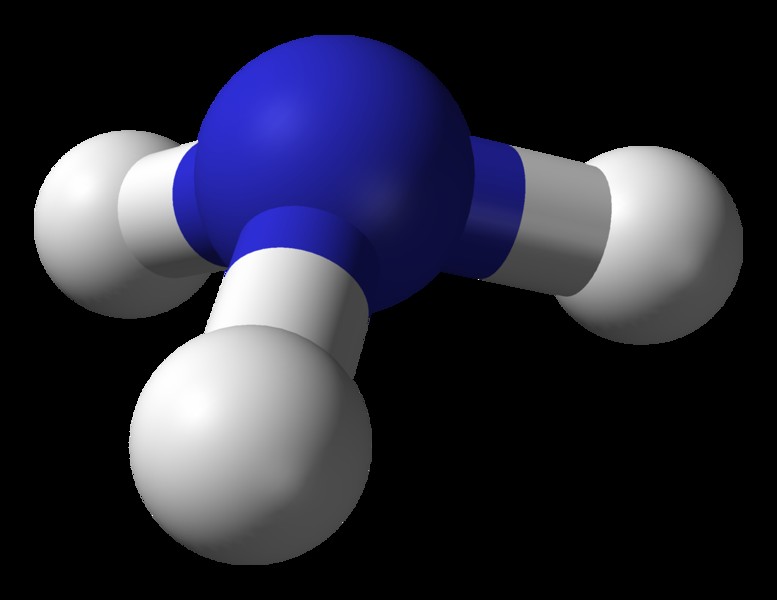
図 5:アンモニア分子の球と棒の構造
アンモニアの電子形状は四面体です。しかし、アンモニアの分子構造は三角錐です。
分子の幾何学
次のチャートは、存在する電子対の数に応じた分子の形状を示しています。
| 電子対の数 | 結合電子対の数 | 孤立電子対の数 | 電子の幾何学 | 分子幾何学 |
| 2 | 2 | 0 | 線形 | 線形 |
| 3 | 3 | 0 | 三角平面 | 三角平面 |
| 3 | 2 | 1 | 三角平面 | 曲がった |
| 4 | 4 | 0 | 四面体 | 四面体 |
| 4 | 3 | 1 | 四面体 | 三角錐 |
| 4 | 2 | 2 | 四面体 | 曲がった |
| 5 | 5 | 0 | 三角錐による三角 | 三角錐による三角 |
| 5 | 4 | 1 | 三角錐による三角 | シーソー |
| 5 | 3 | 2 | 三角錐による三角 | T形 |
| 5 | 2 | 3 | 三角錐による三角 | 線形 |
| 6 | 6 | 0 | 八面体 | 八面体 |
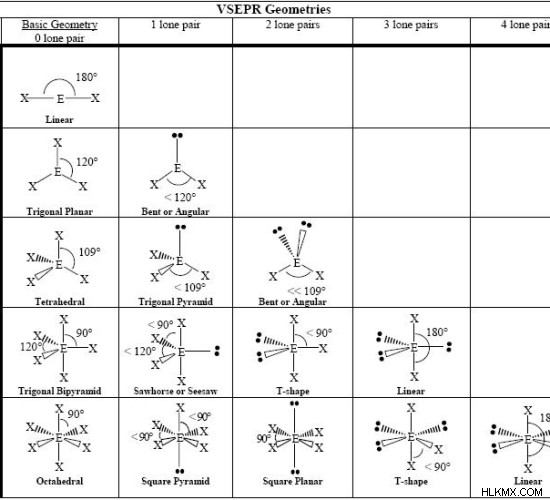
図 6:分子の基本的な形状
上の表は、分子の基本的な形状を示しています。ジオメトリの最初の列は、電子のジオメトリを示しています。他の列には、最初の列を含む分子構造が表示されます。
電子の幾何学と分子の幾何学の違い
定義
電子の幾何学: 電子幾何学は、結合電子対と孤立電子対の両方を考慮して予測される分子の形状です。
分子幾何学: 分子幾何学は、結合電子対のみを考慮して予測される分子の形状です。
孤立電子対
電子の幾何学: 電子ジオメトリを見つける際に、孤立電子対が考慮されます。
分子構造: 分子構造を求める際、孤立電子対は考慮されません。
電子対の数
電子の幾何学: 電子の配置を見つけるには、電子対の総数を計算する必要があります。
分子幾何学: 分子構造を見つけるには、結合電子対の数を計算する必要があります。
結論
中心原子に孤立電子対がない場合、電子の幾何学と分子の幾何学は同じです。しかし、中心原子に孤立電子対がある場合、電子の形状は常に分子の形状とは異なります。したがって、電子の幾何学と分子の幾何学の違いは、分子内に存在する孤立電子対に依存します。







