主な違い – 安定同位体と不安定同位体
同位体は、異なる原子構造を持つ同じ元素の原子です。同じ元素の同位体は、同じ元素の異なる形態であるため、同じ原子番号を持ちます。それらは、核内にある中性子の数によって互いに異なります。元素の原子質量は、陽子の数と電子の数の合計によって決まります。したがって、同位体の原子質量は互いに異なります。同位体は、主に安定同位体と不安定同位体の2つのグループに分けることができます。安定同位体と不安定同位体の主な違いは、安定同位体には安定核があるのに対し、不安定同位体には不安定核があるということです。
対象となる主な分野
1. 安定同位体とは
– 定義、プロパティ、アプリケーション
2. 不安定同位体とは
– 定義、プロパティ、アプリケーション
3. 安定同位体と不安定同位体の違いは何ですか
– 主な違いの比較
重要な用語:アルファ崩壊、安定帯、電子、ヘリウム、同位体、マジック ナンバー、中性子、陽子、放射能、ウラン 
安定同位体とは
安定同位体は、安定した原子核を持つ原子です。それらは核の安定性のために非放射性です。したがって、安定核は放射線を出さない。特定の元素は、複数の安定同位体を持つことができます。ウランなどの一部の元素では、すべての同位体が不安定です。原子核の安定性を決定する 2 つの主要な事実は、陽子と中性子の比率と、陽子と中性子の合計です。
「マジック ナンバー」という現象 」は、最も安定な同位体の原子番号を表す化学の概念です。魔法数は、陽子の数または中性子の数のいずれかです。特定の元素に陽子または中性子の魔法数がある場合、それらは安定同位体です。
マジック ナンバー:2、8、20、28、50、82
プロトン:114
中性子:126、184 は魔法の数です。
さらに、陽子と中性子の数が両方とも偶数である場合、それらの同位体はおそらく安定しています。別の方法は、陽子と中性子の比率を計算することです。 中性子の数と陽子の数の標準的なグラフがあります .陽子:中性子比がそのグラフの安定同位体の領域に適合する場合、それらの同位体は基本的に安定しています。
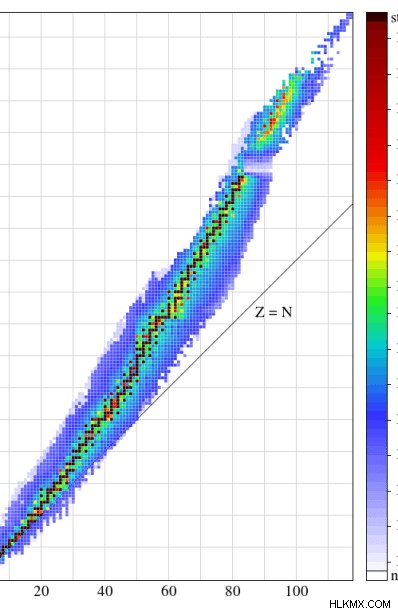
図 1:中性子の数と陽子の数のグラフ。色付きの領域は安定帯と呼ばれます。
安定同位体は放射性ではありませんが、多くの用途があります。たとえば、水素元素には 3 つの主要な同位体があります。それらは、プロチウム、重水素、およびトリチウムです。プロチウムは、その中で最も安定しており、最も豊富な同位体です。トリチウムは最も不安定な同位体です。重水素も安定していますが、自然界にはそれほど豊富ではありません。ただし、プロチウムはほとんどどこにでも見られる同位体です。重水素は、実験室での用途に重水の形で使用できます。
一部の元素には、安定同位体が 1 つしかありません。これらの元素はモノアイソトピックと呼ばれます . 26 のモノアイソトピック元素が知られています。他の元素には複数の安定同位体があります。たとえば、スズ (Sn) には 10 個の安定同位体があります。
不安定同位体とは
不安定同位体は、不安定な原子核を持つ原子です。これらは放射性同位体です。そのため、放射性同位体とも呼ばれます。 .ウランなどの一部の元素には、放射性同位体しかありません。他の元素には、安定同位体と不安定同位体の両方があります。
不安定な要素は、いくつかの理由で不安定になる可能性があります。陽子の数に比べて中性子の数が多いことがその理由の 1 つです。このタイプの同位体では、安定状態を得るために放射性崩壊が起こります。ここで、中性子が陽子と電子に変換されます。これは以下のように与えられます。
0 n → 1 p + -1 e
n は中性子、p は陽子、e は電子です。粒子の質量は大文字の数字で与えられ、電荷は小文字の数字で与えられます。
一部の同位体は、多数の陽子が存在するために不安定です。ここで、陽子は中性子と陽電子に変換できます。陽電子は電子に似ていますが、電荷は +1 です。
1 p → 0 n + 1 e
ここに 1 e は陽電子を示します。
プロトンと電子が多すぎる場合があります。これは、原子質量が非常に大きいことを示しています。次に、2 つの陽子と 2 つの中性子がヘリウム原子として放出されます。これはアルファ崩壊と呼ばれます。
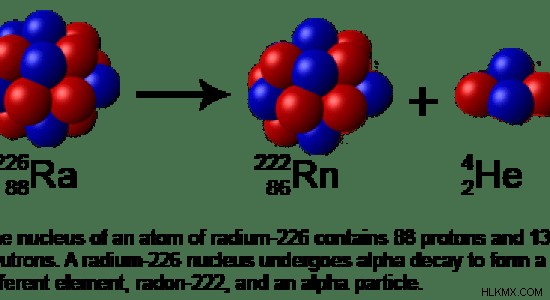
図 2:ラジウム 226 のアルファ崩壊
放射性元素は、研究活動において多くの用途があります。たとえば、これらは化石の年代の決定、DNA 分析、または医療目的などに使用できます。
不安定同位体では、放射性崩壊は半減期で測定できます。物質の半減期は、その物質が崩壊によって最初の質量の半分になるまでの時間として定義されます。
安定同位体と不安定同位体の違い
定義
安定同位体: 安定同位体は、安定した原子核を持つ原子です。
不安定同位体: 不安定同位体は、不安定な原子核を持つ原子です。
放射能
安定同位体: 安定同位体は放射能を示しません。
不安定同位体: 不安定同位体は放射能を示します。
マジック ナンバー
安定同位体: 魔法数は、最も安定な同位体に存在する陽子の数または中性子の数を示します。
不安定同位体: 魔法数は、不安定同位体の陽子や電子の数を示すものではありません。
アプリケーション
安定同位体: 安定同位体は、放射能が存在してはならない用途に使用されます。
不安定同位体: 不安定同位体は、DNA 分析など、放射能が重要な用途で使用されます。
半減期
安定同位体: 安定同位体の半減期は非常に長いか、半減期がまったくありません。
不安定同位体: 不安定同位体の半減期は短く、簡単に計算できます。
結論
地球上のすべての元素は、安定同位体と不安定同位体の 2 つのグループに分けることができます。安定同位体は、非放射性元素の自然発生形態です。不安定同位体は、不安定な原子核を持つ原子です。したがって、これらの要素は放射能を受けます。これが、安定同位体と不安定同位体の主な違いです。放射能は多くの用途で有用ですが、放射線は DNA に突然変異を引き起こし、癌細胞の形成につながる可能性があるため、健康には良くありません。