主な違い – エタノールの燃焼と酸化反応
エタノールは、分子式 C2 を持つアルコールです。 H5 おー。エタノールの化学式はCH3 CH2 おー。エタノールは燃焼反応を起こす可能性があるため、燃料として使用されます。また、酸化反応を受けて、アルデヒド形態およびカルボン酸形態を形成することもあります。エタノールの燃焼反応と酸化反応の主な違いは、エタノールの燃焼反応は常に熱と光を生成しますが、エタノールの酸化反応は常に熱と光を生成するとは限りません。
対象となる主な分野
1.エタノールの燃焼反応とは
– 定義、プロパティ、反応
2.エタノールの酸化反応とは
– 定義、プロパティ、反応
3.エタノールの燃焼反応と酸化反応の違いは何ですか
– 主な違いの比較
キーワード:アルデヒド、バイオ燃料、二酸化炭素、一酸化炭素、カルボン酸、燃焼反応、完全燃焼、完全酸化、エタノール、ガソリン、不完全燃焼、不完全酸化、酸化反応 
エタノールの燃焼反応とは
エタノールの燃焼反応は、エタノールを燃焼させたときに起こる反応です。エタノールは可燃性の高い液体で、燃料として使用できます。エタノールを燃やすと、エネルギーとして熱と光が発生します。したがって、エタノールの燃焼は発熱反応です。エタノールが分子状酸素 (O2 )、それは 2 つの最終製品を形成します。それらは二酸化炭素(CO2 ) と水分子 (H2 O).
エタノールの燃焼は青色の炎で示されます。エタノールの燃焼は、エタノールと酸素の結合を伴う単純なプロセスです。エタノールの燃焼は 2 つの方法で発生します。
- 完全燃焼
- 不完全燃焼

図 01:青い炎はエタノールの完全燃焼を示します。
完全燃焼により CO2 が発生します と H2 O.しかし、不完全燃焼は一酸化炭素(CO)または炭素(C)を生成物として生成します。酸素(O2)が不足すると不完全燃焼が起こります。 )。
エタノールの完全燃焼
CH3 CH2 OH(l) + 3O2(g) → 2CO2(g) + 3H2 O(l)
エタノールの不完全燃焼
CH3 CH2 OH(l) + 2O2(g) → 2CO(g) + 3H2 O(l)
CH3 CH2 OH(l) + O2(g) → C(s) + 3H2 O(l)
不完全燃焼により、多くの場合、一酸化炭素 (CO) ガスと炭素 (C) ダストの混合物が発生します。
エタノールの燃焼によって発生する熱は、車両エンジンのピストンを駆動するために使用されます。エタノールはロケット燃料としても使用できます。さらに、エタノールは植物材料のバイオマスからバイオ燃料として生産することができます。したがって、エタノールは化石燃料よりも環境に優しい特性を示します。
エタノールはガソリンへの優れた添加剤です。ガソリンにエタノールを混合することで、大気汚染物質の排出をいくらか防ぐことができます。ただし、エタノールを燃やすと炎が発生し、汚染物質が放出されます。
エタノールの酸化反応とは
エタノールの酸化反応は、エタノールが酸化剤によって酸化されるときに起こる化学反応です。エタノールの酸化は、最初の生成物としてエタナールと呼ばれるアルデヒドを生成します。それはさらに酸化を受けて、エタン酸として知られるカルボン酸の形を形成することができます.
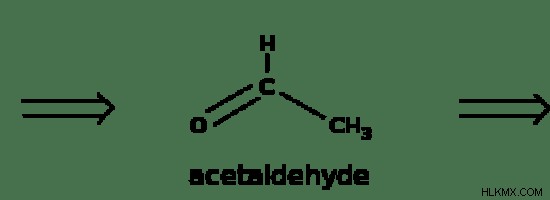
図 2:エタノールの酸化
しかし、エタノールの酸化は触媒の存在下でも起こります。この触媒は、酸化反応の活性化エネルギーを低減するために使用されます。活性化エネルギーが高ければ、反応は開始されません。酸化は 2 段階で発生します:
- 完全酸化
- 不完全な酸化
エタノールが完全に酸化されると、最終生成物としてエタン酸が形成されます。エタノールの不完全な酸化は、最終生成物としてエタナールを形成します。どちらの酸化でも水分子 (H2 O) 副産物として。
エタノールの完全酸化
エタノール + 酸素 → エタノール + 水 → エタン酸 + 水
CH3 CH2 OH(l) + [O] → CH3 CHO(l) + H2 O(l) → CH3 COOH(l) + H2 O(l)
エタノールが完全に酸化されると、反応の最後にエタノールが生成されます。しかし、エタノールの酸化は最初にエタナールを形成し、次にエタナールはさらにエタン酸に酸化されます。
エタノールの不完全酸化
エタノール + 酸素 エタノール + 水
CH3 CH2 OH(l) + [O] → CH3 CHO(l) + H2 O(l)
上記の式で、[O] は酸化剤に由来する原子状酸素を示します。例として、二クロム酸ナトリウム (Na2 Cr2 O7 ) を酸化剤として硫酸 (H2 SO4 ).
CH3 CH2 OH(l) + ナ2 Cr2 O7(aq) + H2 SO4(aq) → CH3 CHO(l) + 2NaCrO4(aq) + 2H2 O(l)
エタノールの酸化には、反応を完了するために触媒または酸化剤が必要です。ただし、エタノールの酸化は、エネルギーが形成されるときに熱や光を生成しません。エタノールの酸化の別の方法は、触媒によるものです。銀触媒はそのような触媒です。エタノール蒸気と空気の混合物を 500℃の銀触媒上に通すことにより、エタノールを酸化することができます。これにより、水 (H2 O).
エタノールの燃焼反応と酸化反応の違い
定義
エタノールの燃焼反応: エタノールの燃焼反応は、エタノールが燃えたときに起こる反応です。
エタノールの酸化反応: エタノールの酸化反応は、エタノールが酸化剤によって酸化されるときに起こる化学反応です。
酸化剤
エタノールの燃焼反応: エタノールの燃焼反応は酸化剤を必要としません。
エタノールの酸化反応: エタノールの酸化反応には、酸化剤の存在が必要です。
触媒
エタノールの燃焼反応: エタノールの燃焼反応は触媒を必要としません。
エタノールの酸化反応: エタノールの酸化反応は、触媒の存在下で起こります。
最終製品
エタノールの燃焼反応: エタノールの酸化反応の最終生成物は、CO2 になる可能性があります 、CO、C、H2 O.
エタノールの酸化反応: エタノールの燃焼反応の最終生成物は、H2 とともにエタナールまたはエタン酸のいずれかになります。 O.
エネルギー形態
エタノールの燃焼反応: エタノールの燃焼反応により、熱と光が発生します。
エタノールの酸化反応: エタノールの酸化反応は、熱と光を生成できません。
結論
燃焼の最終生成物は常に酸化種であるため、燃焼も酸化反応です。さらに、燃焼は酸素と出発物質との結合を伴います。これは、燃焼が酸化反応であることも示しています。これら 2 つの現象には類似点がありますが、エタノールの燃焼反応と酸化反応の違いを区別できる明確な特性があります。