主な違い - 電解結合と共有結合
電子結合と共有結合は、分子または化合物の原子間に見られる 2 種類の化学結合です。これらの結合は、原子をまとめるのに役立ちます。これら 2 種類の結合の形成は、2 つの原子間の電子の交換によって発生します。電子結合はイオン結合とも呼ばれます .これは、2 つの原子間の静電引力です。共有結合は、2 つの原子間で電子を共有した結果です。電子結合と共有結合の主な違いは、2 つの原子が静電引力にあるときに電子結合が形成されるのに対し、2 つの原子が互いに電子を共有するときに共有結合が形成されることです。
対象となる主な分野
1.電子結合とは
– 定義、フォーメーションの説明と例
2.共有結合とは
– 定義、フォーメーションの説明と例
3.電解結合と共有結合の類似点は何ですか
– 共通機能の概要
4.電子結合と共有結合の違いは何ですか
– 主な相違点の比較
重要な用語:共有結合、電気陰性度、静電引力、電子結合、イオン結合、希ガス
電子結合とは
電子結合は、2 つの原子間の静電引力として定義できる化学結合の一種です。ここで、2 つの原子は電子を完全に失うか、完全に獲得します。したがって、2つの原子はイオンになります。電子を失った原子は陽イオンになり、電子を受け取った原子は陰イオンになります。したがって、2 つの原子は反対に帯電したイオンであるため、電子交換後に引力を構築します。この引力が静電引力です。 2 つの原子を一緒に保持してイオン分子を形成すると便利です。
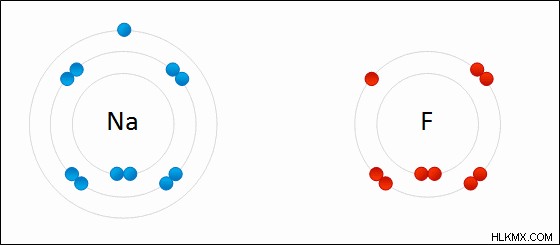
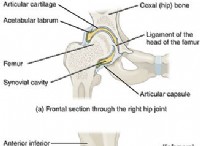
図 01:ナトリウム (Na) 金属と塩素 (Cl) 間のイオン結合の形成
ほとんどの場合、陽イオンは金属です。これは、金属が軌道を満たすために多数の電子を獲得するのではなく、最も外側の軌道にある電子を失う傾向があるためです.次に、陰イオンは非金属になります。これは、非金属が最も外側の軌道ですべての電子を失うのではなく、電子を獲得する傾向があるためです.
このタイプの結合は、電子結合と呼ばれます。これは、原子が引き付け合っているため、電子を完全に失ったり獲得したりしないためです。それらはある程度の共有結合特性を持っています。したがって、これは完全なイオン結合ではありません。
イオン結合の強さは、いくつかの要因に依存します。
- 陽イオンのサイズ – 陽イオンが陰イオンに比べて非常に小さい場合、イオン結合は非常に強力です。
- 陰イオンのサイズ – 陰イオンが陽イオンに比べて非常に大きい場合、イオン結合は非常に強力です
- イオンの電荷 – イオンの電荷が高い場合、イオン結合はより強力になります。
2 つの異なるイオン結合を比較する場合、まず電荷を考慮し、次にイオンのサイズを考慮する必要があります。これらのイオン結合は原子間で形成されます。これは、電子を除去または取得することによって最も近い希ガスの電子配置を取得することによって、それら自体を安定させる必要があるためです。
このほぼ完全な電子移動は、これらの原子の電気陰性度の大きな違いによって引き起こされます。電気陰性度の高い原子は、電気陰性度の低い原子よりも多くの電子を引き付けます。
共有結合とは
共有結合は、2 つの原子間で電子が共有されることによって形成される化学結合の一種です。このタイプの結合は、電気陰性度の値の差が小さい (1.7 未満) か、またはまったくない原子間に形成されます。したがって、ほとんどの非金属はそれらの間に共有結合を形成します。さらに、同じ元素の原子は共有結合のみを形成します。
共有結合には、結合電子対として知られる 2 つの電子があります。この結合電子対は、各原子から供与された電子の対形成によって形成されます。各原子は、1 つの共有結合ごとに 1 つの電子を提供します。したがって、一部の原子は、価電子の数に応じて複数の電子を供与できます。次に、これらの原子は複数の共有結合を持ちます。
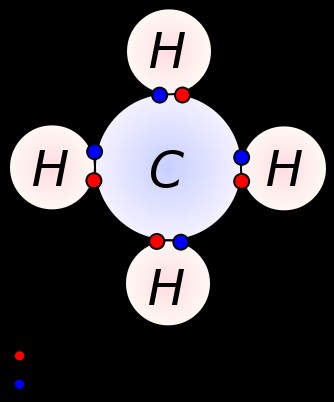
図 2:CH4 分子には 4 つの共有結合があります。したがって、炭素原子の周りには 4 つの結合電子対があります。
共有結合を形成するためには、原子は最も外側の軌道に少なくとも 1 つの不対電子を持っている必要があります。次に、この電子は、別の原子によって共有されている別の電子と対になることができます。不対電子が存在する軌道に応じて、形成される結合はシグマ結合またはパイ結合のいずれかになります。ただし、2つの原子の電気陰性度に応じて、共有結合は極性共有結合または非極性共有結合のいずれかとして存在できます。極性共有結合は、2 つの電気陰性度の値の差が 0.4 ~ 1.7 の場合に形成されます。しかし、電気陰性度の値が 0.4 単位しか違わない場合、それは非極性の共有結合です。
電子結合と共有結合の類似点
- 電気結合と共有結合は化学結合の一種です。
- どちらのタイプも、2 つ以上の原子間の電子交換によって形成されます。
- どちらの結合タイプでも、2 つの原子が結合します。
電子結合と共有結合の違い
定義
電気結合: 電子結合は、2 つの原子間の静電引力として定義できる化学結合の一種です。
共有結合: 共有結合は、2 つの原子間の電子共有によって形成される化学結合の一種です。
絆の性質
電子結合: 電子結合は、2 つの原子間の静電引力の一種です。
共有結合: 共有結合は、2 つの原子間の直接的な化学結合です。
電気陰性度
電気結合: 電子結合を形成するには、原子の電気陰性度の差が 1.7 より大きくなければなりません。
共有結合: 共有結合を形成するには、原子の電気陰性度の差が 1.7 未満でなければなりません。
イオン vs 原子
電子結合: イオンは、電子結合の形成に関与しています。
共有結合: 原子は共有結合の形成に関与しています。
結論
電気結合と共有結合は化学結合の一種です。これらの結合は、原子間の電子交換によって形成されます。 1 つの原子は、複数の電子結合または共有結合を持つことができます。電子結合と共有結合の主な違いは、2 つの原子が静電引力にあるときに電子結合が形成されるのに対し、2 つの原子が互いに電子を共有するときに共有結合が形成されることです。
画像提供:
1. Wdcf による「NaF」 – Commons Wikimedia 経由の自作 (CC BY-SA 3.0)
2. DynaBlast による「Covalent」 – Commons Wikimedia 経由の Inkscape (CC BY-SA 2.5) で作成