理想気体の法則のコア コンセプト
このチュートリアルでは、理想気体の法則式がどのように導き出され、どのように使用するかを学習します。また、理想気体を定義するもの、理想気体定数とは何か、理想気体の法則の単位、理想気体を呼び出すためにどのような仮定を行うか (理想気体の特性) についても学習します。
他の記事で取り上げるトピック
- プレッシャーとは
- ダルトンの分圧の法則
- シャルルの法則
- アボガドロの法則
- ボイルの法則
- ファンデルワールスの方程式
- キネティック ガス理論
- ゲイ・リュサックの法則
- 混合ガス法
- ヘンリーの法則
はじめに
理想気体の法則は、理想気体を記述する状態方程式です。この状態方程式は、気体の圧力、体積、温度、および質量に関連しており、気体が理想的な状態でどのように振る舞うかを記述するのに非常に役立ちます。これは、気体の最も一般的な状態方程式です。
その他のいくつかの注目すべきものは、ファン デル ワールスとビリアルの状態方程式で、どちらも非理想の気体の状態を記述します。 州。詳細については、ファン デル ワールスの方程式に関する記事をご覧ください。
理想気体方程式は、ボイルの法則、シャルルの法則、アボガドロの法則、およびゲイ リュサックの法則の組み合わせとして、1834 年にブノワ ポール エミール クラペイロンによって最初に述べられました。クラペイトンはフランスのエンジニアであり、熱力学の創始者の 1 人です。
理想的な気体の特性とは?
気体は、無作為に互いに衝突し続ける多数の粒子で構成されています。気体の挙動をモデル化して予測するために、理想気体の概念が作成されました。気体が理想的であるためには、いくつかの仮定を行う必要があります。これらは、理想的な気体の特性と見なすこともできます .
<オール>完全に理想的な気体はありませんが、ほとんどの気体は室温で十分に近く、ほぼ理想的です。
気体の法則を理想気体の法則の方程式に統合する
3 つの基本的な気体の法則、シャルルの法則、アボガドロの法則、ボイルの法則を考慮すると、気体の圧力、体積、温度、およびモル数の間の関係を作成できます。それぞれの方程式を組み合わせて、理想気体の法則方程式を導き出すことができます。
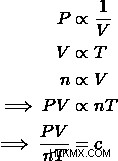
この比例性は気体のすべての状態変化を考慮に入れるため、理想気体では一定になります。この定数は、理想気体定数として知られています 、または普遍気体定数であり、値は 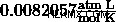 .ラベル付けされたこの定数をプラグインできます
.ラベル付けされたこの定数をプラグインできます  、理想気体の法則を導出する方程式に、
、理想気体の法則を導出する方程式に、  .
.
理想気体法則単位
次の単位は、SI 単位 (国際単位系) が使用される場合、理想気体の法則式で使用されます。
- P はパスカルで測定された圧力です。Pa.
- V は立方メートル、m で測定された体積です
- n はモル数です。
- R =8.3145 は、J/(K · で測定された普遍気体定数です。 モル) 、または代わりに m·Pa / (K · モル)
- T はケルビンで測定された温度です。
パスカルと立方メートルの代わりに、リットルと大気圧を使用している場合は、次のようになります。
- P は大気圧で測定された圧力です
- V はリットル単位で測定された体積です
- n はモル数です。
- R =0.08206 は、L·atm /(K · で測定された普遍気体定数です。 モル)
- T はケルビンで測定された温度です。
理想気体の法則の例題
<オール>

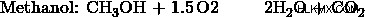
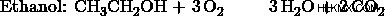
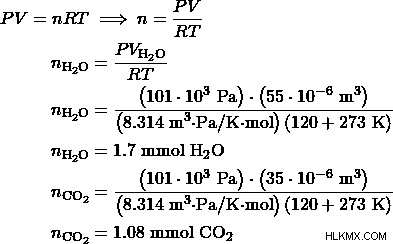
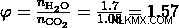
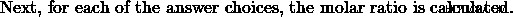
a) エタノール:メタノールの比率を 1:3 とする。すると、エタノール反応の3倍のメタノール反応が起こります。したがって、メタノール製品はエタノール製品の 3 倍になります。
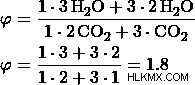
b) 比率を 2:3 とします。
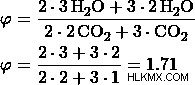
c) 比率を 3:2 とする。
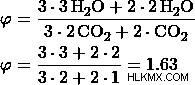
d) 比率を 3:1 とする
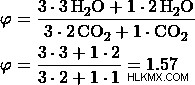
これらの値から、オプション (d) は前に計算したモル比と同じであることがわかり、したがってオプション (d) が正解です。







