主な違い – アノマーとエピマー
異性は、密接に関連する分子間の違いを説明します。異性は、構造異性と立体異性の 2 つの主要なグループに分けられます。構造異性は、同じ化学式に対して異なる構造を示します。立体異性は、同じ分子式を持つ分子の異なる空間配置を示します。アノマーとエピマーは、立体異性体の下にあります。アノマーとエピマーという用語は、炭水化物の構造を説明するために使用されます。これらは、有機化合物の違いを識別するために使用されます。アノマーとエピマーの主な違いは、アノマーはアノマー炭素の構造が互いに異なるのに対し、エピマーは構造内に存在するキラル炭素のいずれかが互いに異なるということです。
対象となる主な分野
1.アノマーとは
– 定義、構造の説明と例
2.エピマーとは
– 定義、構造の説明と例
3.アノマーとエピマーの類似点
– 共通機能の概要
4.アノマーとエピマーの違いは何ですか
– 主な相違点の比較
重要な用語:アノマー、炭水化物、キラル炭素、エピマー、異性、立体異性体、構造異性体
アノマーとは
アノマーは、アノマー炭素の立体配置の違いによって生じる立体異性体です。アノマー炭素は、糖分子の非環式の形でアルデヒドまたはケトン基を持つ炭素原子です。糖分子は、糖分子の非環式形態の一方の端にアルデヒドまたはケトン基があり、もう一方の端にアルコール基があります。より安定になるために、両端のこれらの基は互いに反応して環状糖分子を形成します。この環状形態では、アノマー炭素に-OH基が結合しています。 1 つのアノマー分子のこの -OH 基の位置は、他の分子の位置とは反対方向です。
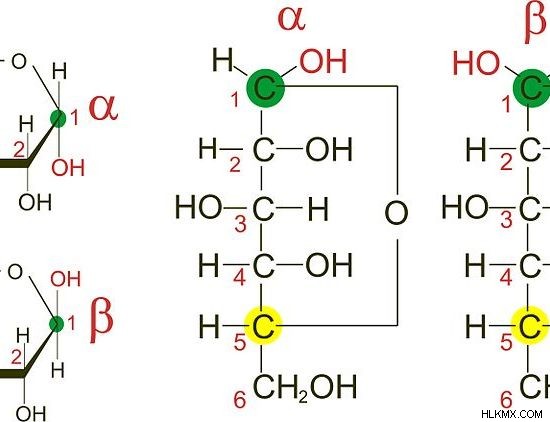
図 1:グルコースの 2 つのアノマー
一方のアノマー体から他方のアノマー体への変換は、アノマー化と呼ばれます。これは可逆プロセスです。ただし、どちらのアノマーも環状構造を持つ安定な分子です。 2 つのアノマーは、アルファ (α) アノマーまたはベータ (β) アノマーと呼ばれます。上の画像に示すように、アルファ アノマーのアノマー炭素に結合した -OH 基は、グルコースのベータ アノマーのそれとは反対の方向です。アノマー炭素は緑色で表示されます。
エピマーとは
エピマーは、1 つのキラル炭素のみが異なる立体異性体の一種です。エピマーはジアステレオマーの一種です。複数のキラル炭素がありますが、エピマーは 1 つの炭素中心でのみ互いに異なります。エピマーは互いに鏡像ではありません。
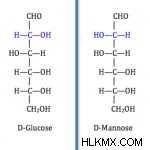
図 2:エピマー
上の画像に示されているように、D-グルコースと D-マンノースはお互いのエピマーです。青く着色された部分は、異性が発生した場所を示します。ここで、-OH基は、D-マンノースでは左側に向けられていますが、D-グルコースでは右側にあります.他の炭素原子もそれらの分子のキラル炭素ですが、互いに同一です。したがって、異性が発生した炭素原子はエピマー炭素と呼ばれます。
アノマーとエピマーの類似点
- アノマーとエピマーのタイプは立体異性体です。
- 1 つの炭素原子の違いにより、両方のタイプが形成されます。
- どちらのタイプも糖分子によく見られます。
- 炭素に結合した 1 つの -OH グループの位置の違いにより、異性が発生します。
アノマーとエピマーの違い
定義
アノマー :アノマーは、アノマー炭素の配置の違いによって生じる立体異性体です。
エピマー: エピマーは、1 つのキラル炭素のみが互いに異なる立体異性体の一種です。
異性化が起こる炭素
アノマー :異性化は、アノマーのアノマー炭素で発生します。
エピマー: 異性化は、エピマーのエピマー炭素で発生します。
糖分子の構造
アノマー :アノマーは環状分子です。
エピマー: エピマーは、非環状分子または環状分子のいずれかです。
結論
アノマーとエピマーは立体異性体です。アノマーの 1 つの形式は、アノマーの反対の形式に変換できます。それをアノマー化といいます。エピマーを形成するプロセスは、エピマー化と呼ばれます。アノマーとエピマーはどちらも 1 つの炭素中心で互いに異なる分子ですが、それらは異なる用語です。







