主な違い – シェル vs サブシェル vs 軌道
原子は物質を構成する基本単位です。これまで科学者たちは、原子はそれ以上分割できないと信じていました。しかし、その後の発見で亜原子粒子に関する情報が明らかになり、原子をさらに亜原子粒子に分割できることが示されました。 3 つの主要な亜原子粒子は、電子、陽子、および中性子です。陽子と中性子が一緒になって、原子の中心核である原子核を作ります。電子はこの原子核の周りを絶え間なく動いています。電子の正確な位置を決定することはできません。ただし、電子は特定の経路で移動します。シェル、サブシェル、および軌道という用語は、電子が移動できる最も可能性の高い経路を指します。シェルサブシェルと軌道の主な違いは、 シェルは同じ主量子数を共有する電子で構成され、サブシェルは同じ角運動量量子数を共有する電子で構成されるのに対し、軌道は同じ電子で構成されることです。エネルギーレベルは異なりますが、スピンは異なります。
対象となる主な分野
1.シェルとは
– 定義、構造、およびプロパティ
2.サブシェルとは
– 定義、構造、およびプロパティ
3.軌道とは
– 定義、構造、およびプロパティ
4.シェルサブシェルとオービタルの違いは何ですか
– 主な相違点の比較
重要な用語:原子、電子、軌道、量子数、シェル、サブシェル 
シェルとは
殻は、原子核の周りの電子がたどる経路です。これらのシェルは、そのシェル内の電子が構成されるエネルギーに従って原子核の周りに配置されるため、エネルギー準位とも呼ばれます。エネルギーが最も低い殻が原子核に最も近い。次のエネルギー レベルは、その殻の向こう側にあります。
これらの殻を識別するために、K、L、M、N などの名前が付けられています。エネルギー レベルが最も低い殻が K 殻です。しかし、科学者は量子数を使用してこれらの殻に名前を付けました。すべてのシェルには独自の量子数があります。シェルに与えられた量子数は、主量子数と呼ばれます。次に、最低エネルギー レベルのシェルは n=1 です。
すべての殻が同じ数の電子を保持しているわけではありません。最も低いエネルギー準位は、最大 2 つの電子しか保持できません。次のエネルギー準位は最大 8 個の電子を保持できます。殻が保持できる電子の数にはパターンがあります。このパターンを以下に示します。
| 主量子数 (n) | 最大電子数 |
| n=1 | 2 |
| n=2 | 8 |
| n=3 | 18 |
| n=4 | 32 |
| n=5 | 32 |
| n=6 | 32 |
したがって、殻が保持できる電子の最大数は 32 です。どの殻も 32 個を超える電子を持つことはできません。上位殻は、下位殻よりも多くの電子を保持できます。
これらのシェルの存在は、原子のエネルギーが量子化されていることを示しています。言い換えれば、原子核の周りを移動する電子には離散的なエネルギー値があります。
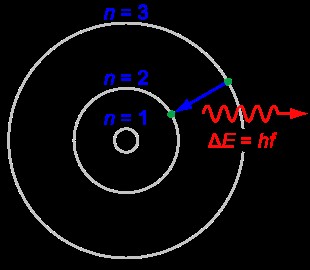
図 1:Atomic Shells
これらの殻の電子は、エネルギーを吸収または放出することによって、ある殻から別の殻に移動できます。吸収または放出されるエネルギーの量は、2 つのシェル間のエネルギー差に等しくなければなりません。そうでない場合、この遷移は発生しません。
サブシェルとは
サブシェルは、シェル内で電子が移動する領域です。これらは、角運動量量子数に従って名前が付けられます。シェルには、主に 4 種類のサブシェルがあります。それらは、s、p、d、f と名付けられています。各サブシェルは、いくつかの軌道で構成されています。サブシェルにある軌道の数は以下のとおりです。
| サブシェル | 軌道の数 | 最大電子数 |
|
| 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
これらのサブシェルも、構成されているエネルギーに従って配置されています。下部シェルでは、サブシェルのエネルギーの昇順は s
図 02:サブシェルの形状
これらのサブシェルには、独自の 3D 構造があります。 s サブシェルは球形です。 p サブシェルはダンベル型です。これらの形状は上に与えられています。 軌道は、電子の波のような挙動を表す数学関数です。言い換えれば、軌道という用語は、電子の正確な動きを説明しています。サブシェルは軌道で構成されています。サブシェルが持つ軌道の数は、サブシェルによって異なります。これは、サブシェルに存在する軌道の数がサブシェル固有の特徴であることを意味します。
サブシェル
軌道の数
1
p
3
d
5
f
10 ただし、1 つの軌道には最大 2 つの電子しか保持できません。これらの電子は同じエネルギー準位にありますが、スピンによって互いに異なります。それらは常に反対のスピンを持っています。電子が軌道に満たされるとき、それらはフントの法則に従って満たされます。この規則は、軌道が二重結合する前に、サブシェル内のすべての軌道が電子で 1 つ占有されていることを示します。
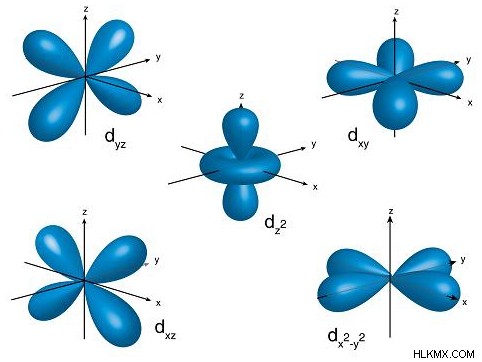
図 3:d 軌道の形状 上の画像は d 軌道の形状を示しています。 1 つの d サブシェルは 5 つの軌道で構成されているため、上の画像はこれらの軌道の 5 つの異なる形状を示しています。
シェル: 殻は、原子核の周りの電子がたどる経路です。
サブシェル: サブシェルは、電子がシェル内を移動する経路です。
軌道: 軌道は、電子の波のような挙動を表す数学関数です。
シェル: シェルには主量子数が与えられます。
サブシェル: サブシェルには角運動量量子数が与えられます。
軌道: 軌道には磁気量子数が与えられます。
シェル: 殻は最大 32 個の電子を保持できます。
サブシェル: サブシェルが保持できる電子の最大数は、サブシェルのタイプによって異なります。
軌道: 軌道が保持できる電子の最大数は 2 です。 原子は、電子、陽子、および中性子で構成されています。陽子と中性子は原子核の中にあります。電子は原子核の周りに雲を形成します。この電子雲には、絶え間なく動いている電子があります。さらなる発見により、これは単なる雲ではないことがわかりました。電子が移動する量子化されたエネルギー準位があります。それらは、電子が移動する経路のように見えます。シェル、サブシェル、および軌道という用語は、これらの経路を説明するために使用されます。シェルサブシェルと軌道の主な違いは、シェルは同じ主量子数を共有する電子で構成され、サブシェルは同じ角運動量量子数を共有する電子で構成されるのに対し、軌道は同じエネルギーレベルにある電子で構成されますが、異なるスピンを持っています。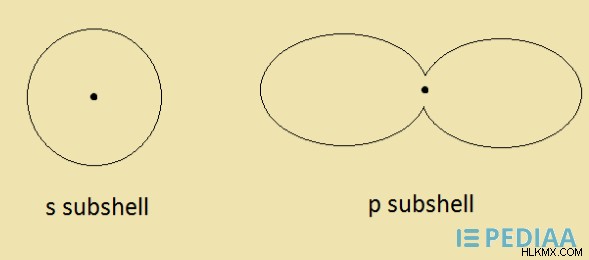
軌道とは
シェル サブシェルとオービタルの違い
定義
量子数の名前
最大電子数
結論