主な違い – 強い電解質と弱い電解質
電解質は、水に溶けるとイオンを生成する物質です。電解質には主に酸、塩基、塩の 3 種類があり、これらの化合物は水に溶解すると解離してイオンになります。正に帯電したイオンと負に帯電したイオンは、これらの化合物の水溶液を介して電気を伝導できます。いくつかの電解質は強い化合物であり、他のものは弱い電解質です。強電解質と弱電解質の主な違いは、強電解質はほぼ完全にイオンに解離できるのに対し、弱電解質は部分的にイオンに解離することです。
対象となる主な分野
1.強電解質とは
– 定義、プロパティ、反応
2.弱電解質とは
– 定義、プロパティ、反応
3.強電解質と弱電解質の違いは何ですか
– 主な相違点の比較
重要な用語:酸、塩基、電解質、塩、強電解質、弱電解質 
強電解質とは
強電解質は、水に溶解すると完全にイオンに解離する化合物です。したがって、強電解質は水に完全に溶解する溶質です。電解質は、陽イオンまたは正電荷を帯びたイオンと陰イオンまたは負電荷を帯びたイオンで構成されます。これらのイオンは、溶液中で電流を伝導できます。
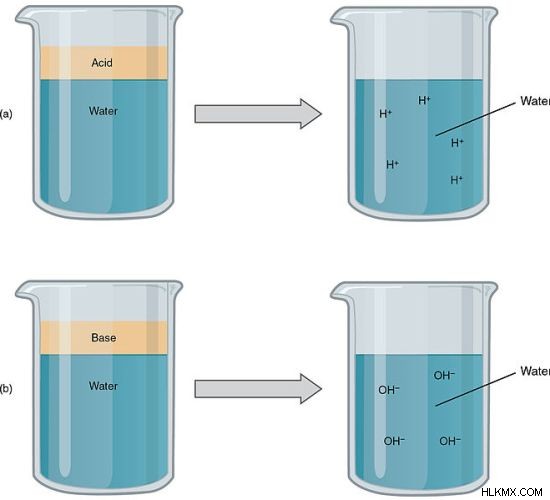
図 1:強酸と強塩基は強電解質です
一般的な強電解質は、強酸、強塩基、およびイオン塩です。ただし、一部の電解質は水に完全に溶けませんが、強力な電解質と見なされます。これは、溶解した量が完全にそのイオンにイオン化されるためです.
たとえば、HCl、HNO3 などの強酸 強い電解質です。これらは完全に陽イオン H と陰イオンに解離します。 NaOH などの強塩基は、電気を伝導できるイオンに完全に解離します。
弱電解質とは
弱電解質は、水に溶解すると部分的にイオンに解離する化合物です。弱電解質は陽イオンと陰イオンで構成されています。これらの化合物のイオン特性は、強力な電解質と比較すると低くなります。一般的な弱電解質は、弱酸、弱塩基、および塩です。
通常、化合物の約 1 ~ 10% がイオンに解離します。ほとんどの窒素含有化合物は弱電解質です。水分子は部分的に H イオンと OH イオンに解離するため、水も弱電解質と見なされます。
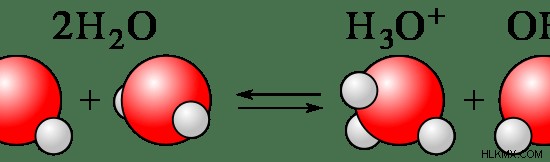
図 2:水分子が部分的に解離してイオンになる
これらの弱電解質は水に部分的に溶解するため、弱電解質の溶液は分子、陽イオン、陰イオンで構成されます。いくつかの荷電イオンがあるため、これらの溶液は電流を伝導できます。
一般的な弱電解質には、H2 などの弱酸があります CO3 、NH3 などの弱塩基 .弱電解質の場合、解離定数は、化合物の解離が電気を伝導できる可溶性イオンを形成するため、溶液を通して伝導できる電荷の容量を予測する上で重要です。
強電解質と弱電解質の違い
定義
強力な電解質: 強力な電解質は、水に溶解すると完全に解離してイオンになる化合物です。
弱電解質: 弱電解質は、水に溶解すると部分的にイオンに解離する化合物です。
解離
強力な電解質: 強力な電解質は完全にイオンに解離できます。
弱電解質: 弱い電解質は部分的にイオンに解離します。
例
強力な電解質: 強電解質は、強酸、強塩基、および一部の塩です。
弱電解質: 弱電解質は、弱酸、弱塩基、および一部の塩です。
結論
電解質は、水に溶けて陽イオンと陰イオンを放出する化合物です。これらのイオンは、溶液中の電気伝導に寄与することができます。強電解質と弱電解質の主な違いは、強電解質はほぼ完全にイオンに解離できるのに対し、弱電解質は部分的にイオンに解離することです。







