主な違い – 同素体と同位体
化学元素は、いくつかの異なる形態で自然に発生します。元素は他の元素と組み合わせて見つかることもあれば、金 (Au) などの元素の形で見つかることもあります。ただし、一部の要素は自然に異なる形で発生しますが、同じ物理的状態にあります。そのような元素は同素体と呼ばれます。原子構造の異なる形態を持つ要素もあります。それらは同位体と呼ばれます。同位体と同位体の主な違いは、同位体は原子レベルで定義されるのに対し、同位体は分子レベルで定義されることです。
対象となる主な分野
1.同素体とは
– 定義、プロパティ、例
2.同位体とは
– 定義、プロパティ、例
3.同素体と同位体の違いは何ですか
– 主な相違点の比較
重要な用語:同素体、同素体、炭素、金、水素、同位体、硫黄 
同素体とは
同素体は、同じ物理的状態で安定している同じ化学元素の異なる形態です。同素体では、同じ元素の原子が異なる方法で互いに結合しています。つまり、原子の空間配置は同素体ごとに異なります。同素体は、同じ元素の原子のみで構成されています。異なる元素の原子の組み合わせはありません。
同じ化学元素の同素体の物理的状態は同じです。しかし、同素体の分子式は、互いに等しい場合も異なる場合もあります。したがって、同素体の化学的および物理的特性は互いに異なる場合があります。
同素体とは、特定の化学元素の同素体の有無を表す用語です。すべての化学元素が同素体を持っているわけではありません。一部の元素のみが同素体を示します。いくつかの一般的な例を以下で説明します。
炭素 (C)
炭素は、同素体を示す主要な化学元素です。炭素の最も一般的な同素体はグラファイトとダイヤモンドです。グラファイトもダイヤモンドも炭素原子のみで構成されています。しかし、分子構造、炭素原子の混成、およびそれらの他の物理的特性は互いに異なります.
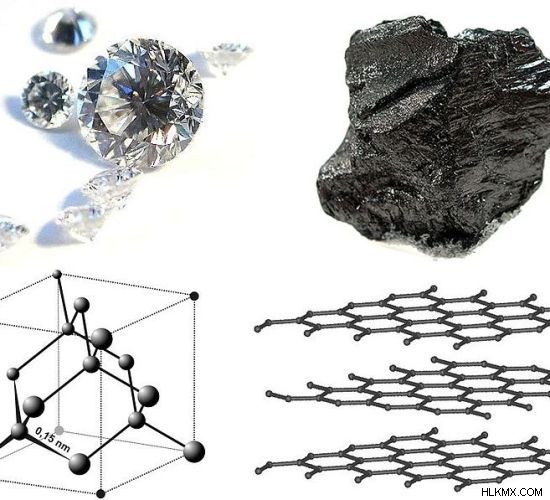
図 01:ダイヤモンドとグラファイトの化学構造と外観
酸素
酸素の同素体は二酸素 (O2 ) とオゾン (O3 )。どちらも本質的に気相にあり、分子構造、化学的および物理的特性によって互いに異なります.
硫黄
自然界の硫黄は S8 として検出されます 単位。これらの単位は、8 つの硫黄原子で構成されています。ここでは、1つの硫黄原子が他の2つの硫黄原子と結合して環状構造を形成しています。これらの環状構造は、菱形構造、針状(単斜晶)または斜方晶のいずれかであることができます。 S8 の一般的な構造 はクラウン構造です。
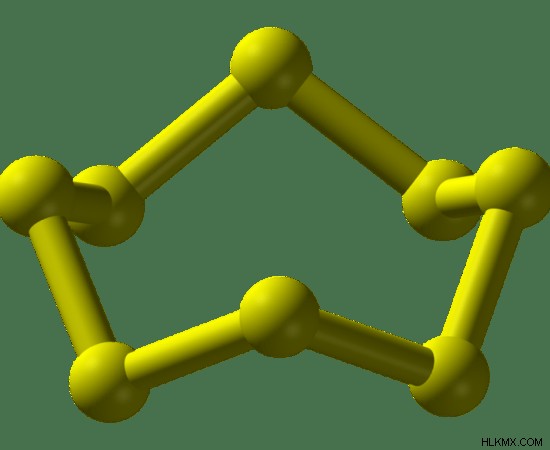
図 02:S8 のクラウン構造
同素体は、物理状態の分子に対して定義されます。したがって、液体の水と氷はどちらも水分子 (H2 O).
同位体とは
同位体は、同じ化学元素の異なる形態の原子構造です。一般に、原子は原子核と、この原子核を取り囲む電子雲からできています。原子核は陽子と中性子で構成されていますが、電子雲は電子だけで構成されています。要素は、一意の数の陽子で構成されています。元素の原子番号は陽子の数です。したがって、各化学元素には固有の原子番号があります。元素の周期表は、元素の原子番号に基づいて作成されます。ここでは、化学元素を原子番号の昇順に並べています。ただし、原子核に存在する中性子の数は、元素固有の値ではありません。同じ元素の原子は、核内に異なる数の中性子を持っている場合があります。これらの原子は同位体と呼ばれます。
特定の元素の同位体は、安定または不安定のいずれかです。不安定な同位体は、安定した形を得るために放射性崩壊を受けることがあります。最も一般的な同位体の一部を以下に示します。
水素 (H)
水素の原子番号は 1 です。したがって、1 つの陽子で構成されています。水素の3つの一般的な同位体があります。それらは、プロチウム、重水素、およびトリチウムです。 Protium には中性子がありません。重水素には 1 つの中性子があり、トリチウムには 2 つの中性子があります。
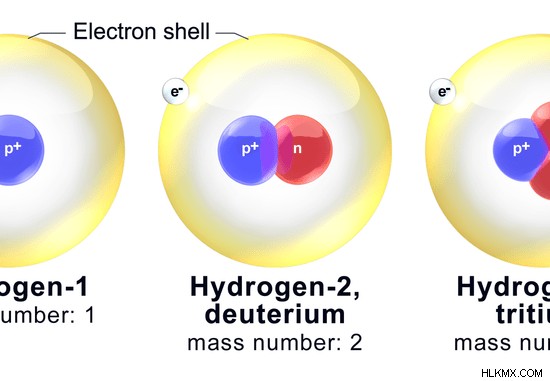
図 03:水素の同位体
ヘリウム
ヘリウムは 2 つの陽子で構成されています。自然に発生するヘリウム同位体には、中性子が 1 つまたは 2 つ含まれています。
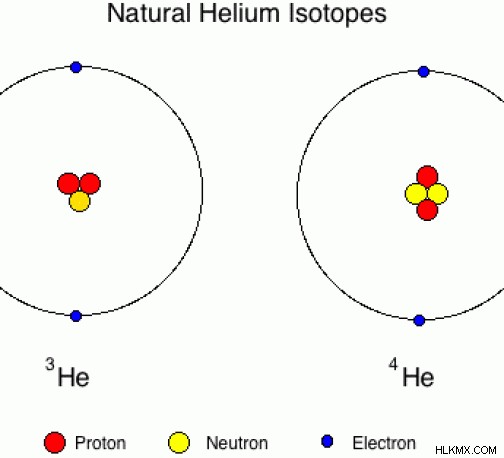
図 04:ヘリウムの同位体
カーボン
炭素原子は同位体の形でも発生します。炭素の最も一般的な同位体は、6 個の中性子で構成されています。一部の炭素同位体には 7 個または 8 個の中性子があります。
同素体と同位体の違い
定義
同素体: 同素体は、同じ物理的状態で安定している、同じ化学元素の異なる形態です。
同位体: 同位体は、同じ化学元素の異なる形態の原子構造です。
自然
同素体: 同素体は分子構造を記述します。
同位体: 同位体は原子構造を表します。
質量
同素体: 同素体のモル質量は、互いに等しい場合と異なる場合があります。
同位体: 同位体の原子番号は同じですが、原子質量は互いに異なります。
豊かさ
同素体: 同素体はすべての化学元素に見られるわけではありません.
同位体: 同位体はほぼすべての元素に含まれています。
化学的性質
同素体: 同素体の化学的性質は互いに異なります。
同位体: 同位体の化学的性質は、同じ数の電子が存在するため類似しています。
安定性
同素体: 同素体は、天然に存在する安定した分子です。
同位体: 同位体には安定なものもあれば、不安定なものもあります。
結論
同素体と同位体はどちらも、特定の化学元素の異なる形態を指します。同素体は、分子構造の違いを説明します。同位体は原子構造の違いを説明します。これが同素体と同位体の主な違いです。同素体は、その特性に非常にわずかな違いがある場合もあれば、大きな違いがある場合もあります。しかし、ほとんどの同位体は、他の特性ではなく、安定性によって互いに異なります。同位体は同じ数の電子を持っているため、同位体の化学的性質は同じです。ほとんどすべての化学的性質は、電子の数と配置に依存しています。